题目内容
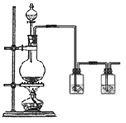
【题目】用如下图所示装置进行实验,请回答下列问题:

Ⅰ.(1)若通入SO2气体,请填写表中空格:
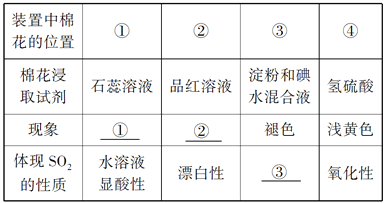
①________________ ②________________ ③________________
(2)写出③中反应的离子方程式:__________________________。
Ⅱ.若通入HCl气体,装置中的四处棉花依次做了如下处理:①包有用水润湿的某固体物质;②浸有KI溶液;③浸有石蕊溶液;④浸有浓NaOH溶液。请回答:
(1)观察到②处有棕黄色物质产生,则:①处包有的某固体物质可能是下列的________(填序号),其反应的离子方程式为________________________。
a.MnO2 b.KMnO4 c.KCl d.Cu
(2)实验过程中,在③处能观察到___________________________。
(3) 实验室一般用二氧化锰与浓盐酸反应制取氯气,当生成7.1gCl2时,被氧化的HCl的物质的量为_____。
【答案】 变红 褪色 还原性 I2+SO2+2H2O===SO42-+4H++2I- b 2MnO4-+10Cl-+16H+===2Mn2++5Cl2↑+8H2O 先变红后褪色 0.2mol
【解析】I.(1)①二氧化硫能和水反应生成亚硫酸,亚硫酸能电离出氢离子使溶液呈酸性,石蕊试液遇酸变红色;②二氧化硫有漂白性,能使品红溶液褪色; ③二氧化硫有还原性,碘有氧化性,二氧化硫和碘能发生氧化还原反应而使淀粉和碘水混合液褪色;(2)二氧化硫能和碘发生氧化还原反应生成硫酸和氢碘酸,离子方程式为I2+SO2+2H2O=SO42-+4H++2I-;
Ⅱ.(1)氯化氢和碘化钾不反应,但氯化氢有还原性,能被强氧化剂氧化生成氯气,所以应选取强氧化剂,能把氯化氢氧化成氯气,具有强氧化性的物质只有高锰酸钾,答案选b;发生的离子方程式为2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;(2)氯气和水反应生成盐酸和次氯酸,所以溶液呈酸性,石蕊试液遇酸显红色;次氯酸有漂白性,而使溶液褪色,所以看到的现象是先变红后褪色;(3)7.1g氯气的物质的量是7.1g÷71g/mol=0.1mol,则根据氯原子守恒可知被氧化的氯化氢是0.2mol。

【题目】某中学化学实验小组为了证明和比较SO2与氯水的性质,设计了如下装置:
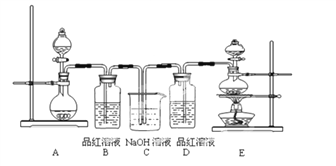
(1)实验室常用装置E制备Cl2,反应中浓盐酸所表现出的性质是__________。
(2)反应开始后,发现B、D两个容器中的品红溶液都褪色,停止通气后,给B、D加热,B中的现象为:_____________________。
(3)装置C的作用是_____________________。
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验:
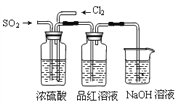 通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答问题。
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,品红溶液不褪色的原因是(用方程式表示):_____________。
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?____________________。
(5)二氧化硫容易造成酸雨,现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下表:
测试时间/h | 0 | 1 | 2 | 3 | 4 |
雨水的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
分析数据,回答下列问题:
①雨水样品的pH变化的原因是(用化学反应方程式表示)_____________。
②你认为减少酸雨产生的途径可采用的措施是________。
A.少用煤作燃料 B.把工厂烟囱造高
C.燃料脱硫 D.在已酸化的土壤中加石灰 E.开发新能源
(6)实验中需要用干燥纯净的氯气,下列装置图第一个洗气瓶中盛放的液体为_____________。