题目内容
【题目】常温下,下列各组数据中比值为2:1的是
A.熔融NaHSO4电离出的阳离子与阴离子之比
B.0.2mol·L-1的CH3COOH溶液与0.1mol·L-1的盐酸中c(H+)之比
C.pH=7的氨水与(NH4)2SO4的混合溶液中,c(NH![]() )与c(SO
)与c(SO![]() )之比
)之比
D.pH=12的Ba(OH)2溶液与pH=12的KOH溶液中c(OH-)之比
【答案】C
【解析】
试题分析:A、熔融NaHSO4电离出的阳离子与阴离子之比为1:1,故A错误;B、CH3COOH为弱电解质,不能完全电离,0.2molL-1的CH3COOH溶液与0.1molL-1的盐酸中c(H+)之比小于2:1,故B错误;C、溶液呈电中性,则有c(NH4+)+c(H+)=2c(SO42-)+c(OH-),pH=7,则c(H+)=c(OH-),所以c(NH4+)与c(SO42-)之比为2:1,故C正确;D、pH=12的Ba(OH)2溶液中c(Ba(OH)2)=![]() ×c(OH-)=0.005mol/L,pH=12的KOH溶液中c(KOH)=c(OH-)=0.01mol/L,二者比值为1:2,故D错误;故选C。
×c(OH-)=0.005mol/L,pH=12的KOH溶液中c(KOH)=c(OH-)=0.01mol/L,二者比值为1:2,故D错误;故选C。

练习册系列答案
相关题目
【题目】某同学进行下列实验:
操作 | 现象 |
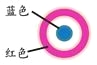
取一块打磨过的生铁片,在其表面滴1滴含酚酞和K3[Fe(CN)6]的食盐水 |
放置一段时间后,生铁片上出现如右图所示“斑痕”。其边缘处为红色,中心区域为蓝色,在两色环交界处出现铁锈 |
下列说法不合理的是
A. 生铁片发生吸氧腐蚀
B. 中心区:Fe–2e—==Fe2+
C. 边缘处:O2+2H2O+4e—==4OH—
D. 交界处:4Fe2++O2+10H2O==4Fe(OH)3+8H+