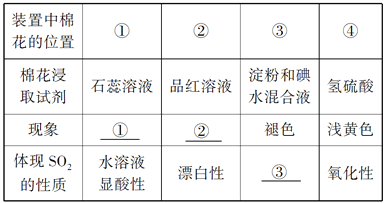
题目内容
【题目】某中学化学实验小组为了证明和比较SO2与氯水的性质,设计了如下装置:
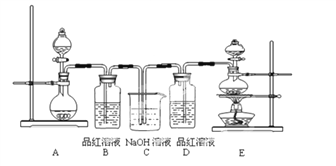
(1)实验室常用装置E制备Cl2,反应中浓盐酸所表现出的性质是__________。
(2)反应开始后,发现B、D两个容器中的品红溶液都褪色,停止通气后,给B、D加热,B中的现象为:_____________________。
(3)装置C的作用是_____________________。
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验:
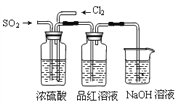 通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答问题。
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,品红溶液不褪色的原因是(用方程式表示):_____________。
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?____________________。
(5)二氧化硫容易造成酸雨,现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下表:
测试时间/h | 0 | 1 | 2 | 3 | 4 |
雨水的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
分析数据,回答下列问题:
①雨水样品的pH变化的原因是(用化学反应方程式表示)_____________。
②你认为减少酸雨产生的途径可采用的措施是________。
A.少用煤作燃料 B.把工厂烟囱造高
C.燃料脱硫 D.在已酸化的土壤中加石灰 E.开发新能源
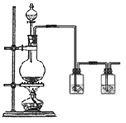
(6)实验中需要用干燥纯净的氯气,下列装置图第一个洗气瓶中盛放的液体为_____________。
【答案】 还原性与酸性 B又变红色,D还是无色 尾气吸收,防污染 Cl2+SO2+2H2O=2HCl+H2SO4 让氯气或二氧化硫之一过量即可 2H2SO3+O2=2H2SO4 ACE 饱和食盐水
【解析】(1)实验室常用装置E制备Cl2,反应中氯元素化合价升高,另外还有氯化锰生成,因此浓盐酸所表现出的性质是还原性与酸性;(2)A装置产生SO2,SO2的漂白是不稳定的,加热后可以复原,因此B中的现象为又变红色。氯气溶于水产生的次氯酸具有强氧化性,能漂白有色物质,是不可逆的,因此加热后D中的实验现象是还是无色;(3)SO2和氯气均是大气污染物,所以装置C的作用是尾气吸收,防污染;(4)①氯气具有强氧化性,能把SO2氧化为硫酸,从而失去漂白性,反应的方程式为Cl2+SO2+2H2O=2HCl+H2SO4;②只要反应中氯气或SO2之间有过量的即可使品红溶液褪色。(5)①二氧化硫溶于水生成弱酸亚硫酸,亚硫酸易被氧化为强酸硫酸,所以pH逐渐减小,反应的化学方程式为2H2SO3+O2=2H2SO4;②A.少用煤作燃料可以减少SO2排放,A正确;B.把工厂烟囱造高并不能减少SO2排放,B错误;C.燃料脱硫可以减少SO2排放,C正确;D.在已酸化的土壤中加石灰属于污染后的治理,不能减少SO2排放,D错误;E.开发新能源可以减少SO2排放,E正确,答案选ACE;(6)生成的氯气中含有挥发出的氯化氢,可以用饱和食盐水除去氯气中的氯化氢气体。

 阅读快车系列答案
阅读快车系列答案