题目内容
元素在周围表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是
| A.同一元素不可能既表现金属性,又表现非金属性 |
| B.第三周期元素的最高正化合价等于它所处的主族序数 |
| C.短周期元素形成离子后,最外层都达到8电子稳定结构, |
| D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
B
解析试题分析:A、处于金属和非金属分界线的元素既有金属性又有非金属性,如硅元素,A选项错误;
B、第三周期的元素从Na到Cl最高化合价从正一价到正七价和族序数相等,B选项正确;
C、H元素、Li元素形成离子后达到2电子结构和氦结构相同,不是8电子稳定结构,C选项错误;
D、第一主族的所有元素最外层都为一个电子,但是H元素与Na元素性质差异很大,同一主族的元素的原子,最外层电子数相同,化学性质相似,D选项错误,答案选B。
考点:考查原子结构与元素的性质
点评:该题是高考中的常见题型,属于中等难度的试题。本题考查了元素周期律知识.对此类题目既要考虑元素在周期表中的位置、元素的原子结构和性质之间的关系,又要注意规律的特殊性,如核外电子排布的周期性变化中,第一周期最外层电子数从1→2,而不是从1→8的变化;同周期化合价变化规律中,第2周期的F、O不符合等

练习册系列答案
相关题目
下图是部分短周期主族元素原子半径与原子序数的关系图,下列说法正确的是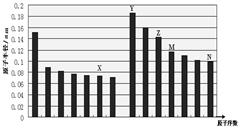
| A.最高价含氧酸的酸性:M>N |
| B.离子半径:X<Y |
| C.X和Y形成的化合物中一定含有含离子键 |
| D.化合物MX2能与碱反应,不能与任何酸反应 |
下表是部分短周期元素的相关信息:
| 元素代号 | L | M | T | Q | R |
| 原子半径/nm | 0.154 | 0.130 | 0.118 | 0.102 | 0.073 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | -2 |
下列判断正确的是
A.沸点:H2Q>H2R
B.碱性:T(OH)3>M(OH)2
C.T和Q两者最高价氧化物对应的水化物可以发生反应
D.L与R形成的化合物中只能含有离子键
在物质结构研究的历史上,首先提出原子内有电子学说的科学家是
| A.道尔顿 | B.卢瑟福 | C.汤姆生 | D.波尔 |
下列离子中,与Na+含有相同电子数的是
| A.F- | B.Cl- | C.Br- | D.I- |
下列有关物质性质的比较中,正确的是( )
①沸点:H2O>HCl>HF ②密度:四氯化碳>水>汽油
③酸性:H3PO4>H2SO4>HClO4 ④离子半径:O2->F->Na+
| A.①③ | B.②④ | C.①④ | D.②③ |
与元素的化学性质关系最密切的是( )。
| A.质子数 | B.中子数 | C.核电荷数 | D.最外层电子数 |
元素性质呈现周期性变化的基本原因是
| A.元素的原子量逐渐增大 | B.核外电子排布呈周期性变化 |
| C.核电荷数逐渐增大 | D.元素化合价呈周期性变化 |