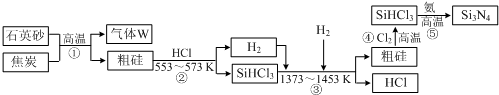
题目内容
5.现有一包20g该混合物,其中可能含有氧化铁,氧化铜和氧化铝.为了确定该混合物的组成,某学习小组做了如下实验:①取5g该混合物固体,用足量的盐酸溶解,发现所得溶液显蓝色,无固体剩余 ②再取5g该混合物,用足量的氢氧化钠溶液溶解,发现所得溶液显无色,有黑色固体剩余,过滤,洗涤固体残余物,晾干,称量,剩余固体的质量是1.94g.(1)该混合物中,n(氧化铁)=0,n(氧化铝)=0.12mol
(2)溶解20g该混合物固体消耗2mol•L-1盐酸体积是多少毫升?
分析 取5g该混合物固体,用足量的盐酸溶解,发现所得溶液显蓝色,无固体剩余,说明固体中一定含有氧化铜;
②再取5g该混合物,用足量的氢氧化钠溶液溶解,发现所得溶液显无色,有黑色固体剩余,过滤,洗涤固体残余物,晾干,称量,剩余固体的质量是1.94g,说明溶液中一定含有氧化铝和氧化铜,其中氧化铜的质量为1.94g,氧化铝的质量为:5g-1.94g=3.06g,
(1)根据分析计算出20g混合物中含有的氧化铝、氧化铜的物质的量,混合物中不含氧化铁;
(2)混合物与盐酸反应生成AlCl3、CuCl2,根据质量守恒计算出消耗盐酸的总物质的量,再根据V=$\frac{n}{c}$计算出消耗盐酸的体积.
解答 解:取5g该混合物固体,用足量的盐酸溶解,发现所得溶液显蓝色,无固体剩余,说明固体中一定含有氧化铜;
②再取5g该混合物,用足量的氢氧化钠溶液溶解,发现所得溶液显无色,有黑色固体剩余,过滤,洗涤固体残余物,晾干,称量,剩余固体的质量是1.94g,说明溶液中一定含有氧化铝和氧化铜,其中氧化铜的质量为1.94g,氧化铝的质量为:5g-1.94g=3.06g,
(1)根据分析可知,混合物中含有3.06g氧化铝,1.94gCuO,不含氧化铁,含有氧化铝的物质的量为$\frac{3.06g}{102g/mol}$×$\frac{20g}{5g}$=0.12mol,
故答案为:0;0.12mol;
(2)1.94g氧化铜的物质的量为:$\frac{1.94g}{80g/mol}$=0.02425mol,原混合物中含有氧化铜的物质的量为0.02425mol×$\frac{20g}{5g}$=0.097mol,
氧化铜、氧化铝与盐酸反应生成AlCl3、CuCl2,则20g混合物与足量盐酸反应消耗HCl的总物质的量为n(HCl)=0.12mol×3+0.097mol×2=0.554mol,
消耗2mol/L的盐酸的体积为:$\frac{0.554mol}{2mol/L}$=0.227L=227mL,
答:溶解20g该混合物固体消耗2mol•L-1盐酸体积是227mL.
点评 本题考查了混合物反应的计算,题目难度中等,正确判断混合物组成为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的化学计算能力.

 阅读快车系列答案
阅读快车系列答案①通过减小容器体积增大压强 ②升高温度 ③将炭粉碎
④通入CO2 ⑤增加炭的量 ⑥恒容条件下通入N2.
| A. | ①②③⑥ | B. | ①②④⑥ | C. | ①②③④ | D. | ①②③④⑤ |
| A. | 除去二氧化碳中混有的少量一氧化碳:通入适量氧气后点燃 | |
| B. | 除去硝酸钾晶体里少量的氯化钠:加水溶解,蒸发结晶至有大量晶体析出,停止加热用余热蒸干 | |
| C. | 除去氮气中少量氧气:使气体通过炽热的铜粉 | |
| D. | 除去氯化钠固体中少量的纯碱:加入足量氯化钙,过滤、蒸发、结晶 |
| A. | 溶液密度ρ可表示为$\frac{cMr}{1000w}$ | |
| B. | 物质的量浓度c可表示为$\frac{ρV}{MrV+22.4m}$ | |
| C. | 溶液的质量分数w%可表示为$\frac{MrV}{22.4m}$ | |
| D. | 相对分子质量Mr可表示为$\frac{22.4m×w%}{(1-w%)V}$ |

| A. | 用图甲装置构成锌一铜原电池 | B. | 用图乙装置除去N02中的N0 | ||
| C. | 用图丙装置制备SO2气体 | D. | 用装置丁除去氨气中的水蒸气 |
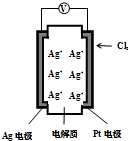 如图所示,利用2Ag+Cl2═2AgCl设计的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质).下列分析不正确的是( )
如图所示,利用2Ag+Cl2═2AgCl设计的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质).下列分析不正确的是( )| A. | 空气中c(Cl2)越大,Ag极消耗速率越快 | |
| B. | Ag+向Pt电极移动 | |
| C. | 电子由Ag电极经外电路流向Pt电极 | |
| D. | Ag电极上发生了还原反应 |