题目内容
17.有11.0gNaCl和NaBr的混合物溶于水,通人足量的氯气,完全反应后,把熔液蒸干,得到残余物8.78g,求原混合物中NaCl的质量分数.分析 NaCl和NaBr的混合物中通入氯气后,只有NaBr发生反应,NaCl不反应,所以固体的质量变化是由NaBr变为NaCl引起的,且生成的Br蒸于、灼烧时挥发,最后的固体只有NaCl,据此利用差量法进行计算.
解答 解:NaCl和NaI的混合物中通入氯气后,只有NaI发生反应,NaCl不反应,所以固体的质量变化是由NaI变为NaCl引起的,且生成的I2蒸于、灼烧时会升华,最后的固体只有NaCl.设混合物中NaI的质量为x.
2NaBr+Cl2=2NaCl+Br2 △m
206 117 206-117=89
x 11g-8.78g=2.22g
x=$\frac{206×2.22g}{89}$=5.138g,
则NaCl的质量为:m=11g-g=5.86g,
NaCl的质量分数为:w(NaCl)=$\frac{5.86g}{11.0g}$×100%≈53.3%,
答:原混合物中氯化钠的质量分数为53.3%.
点评 本题考查混合物反应计算,题目难度中等,明确发生反应的原理为解答关键,注意利用守恒法解答,侧重考查学生的分析、理解能力及化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.下列设计的实验方案能达到实验目的是( )
| A. | 通过灼热的镁粉除去N2中的O2 | |
| B. | 用湿润碘化钾淀粉试纸鉴别Br2(g)和NO2 | |
| C. | 向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体 | |
| D. | 检验溶液中是否有SO42-:先将溶液用足量的盐酸酸化,再加入BaCl2溶液 |
12.下列物质不能用于干燥SO2气体的是( )
| A. | 浓硫酸 | B. | 碱石灰 | C. | 无水氯化钙 | D. | 五氧化二磷 |
2.下列各项操作中,发生“先产生沉淀,然后沉淀质量减少,但沉淀不消失”现象的是( )
①向MgCl2和AlCl3的混合溶液中逐滴加入过量NaOH
②向KAl(SO4)2溶液中逐滴加入过量Ba(OH)2
③向AgNO3溶液中逐滴加入过量氨水
④向Na2SiO3溶液中逐滴加入过量的盐酸.
①向MgCl2和AlCl3的混合溶液中逐滴加入过量NaOH
②向KAl(SO4)2溶液中逐滴加入过量Ba(OH)2
③向AgNO3溶液中逐滴加入过量氨水
④向Na2SiO3溶液中逐滴加入过量的盐酸.
| A. | ①② | B. | 只有① | C. | ②③ | D. | ①②④ |
9.分类思想是中学化学的核心思想,分类均有一定标准,下列有关说法正确的是( )
| A. | Al2O3、NaHCO3均可与强酸、强碱反应,都为两性物质 | |
| B. | Na2O2、AlCl3在适当条件下均可导电,都为电解质 | |
| C. | CuCl2与FeCl3均可与Fe发生置换反应,都可充当氧化剂 | |
| D. | BaCO3、BaSO4、Ba(OH)2均难溶于水,所以均属于难溶电解质 |
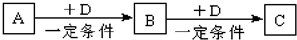 已知A、B、C是中学化学的常见物质,它们在一定条件下有如图转化关系:
已知A、B、C是中学化学的常见物质,它们在一定条件下有如图转化关系: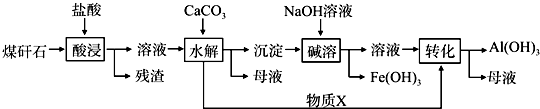

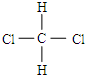 和
和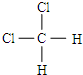 E、CH3CH2CH2CH3和
E、CH3CH2CH2CH3和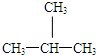
 HCO3-+OH-
HCO3-+OH-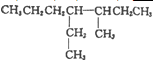 的系统命名为:3-甲基-4-乙基-庚烷
的系统命名为:3-甲基-4-乙基-庚烷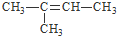 .
.