题目内容
15.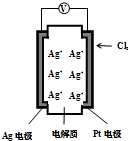 如图所示,利用2Ag+Cl2═2AgCl设计的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质).下列分析不正确的是( )
如图所示,利用2Ag+Cl2═2AgCl设计的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质).下列分析不正确的是( )| A. | 空气中c(Cl2)越大,Ag极消耗速率越快 | |
| B. | Ag+向Pt电极移动 | |
| C. | 电子由Ag电极经外电路流向Pt电极 | |
| D. | Ag电极上发生了还原反应 |
分析 Ag电极为负极发生氧化反应生成银离子,氯气在正极发生还原反应生成氯离子,氯离子与银离子反应生成AgCl沉淀,据沉淀质量测定氯气含量,据此分析.
解答 解:A、反应原理是Ag与氯气反应,空气中c(Cl2)越大,氯气在正极反应生成氯离子速度越快,Ag消耗越快,故B正确;
B、电池工作时,电解质中Ag+向正极移动,即向Pt电极移动,故B正确;
C、电子从负极Ag流向正极Pt,故C正确;
D、Ag电极为负极发生氧化反应生成银离子,故D错误;
故选D.
点评 本题考查了原电池原理的应用,注意电解反应类型和电子移动方向,题目难度不大.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
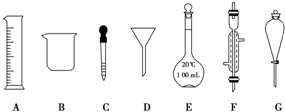 实验是化学研究的一种重要手段,现有如图所示A~G七种仪器,请根据要求填空.
实验是化学研究的一种重要手段,现有如图所示A~G七种仪器,请根据要求填空.
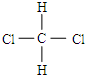 和
和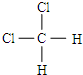 E、CH3CH2CH2CH3和
E、CH3CH2CH2CH3和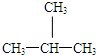
 HCO3-+OH-
HCO3-+OH-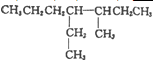 的系统命名为:3-甲基-4-乙基-庚烷
的系统命名为:3-甲基-4-乙基-庚烷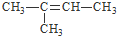 .
.