题目内容
【题目】(1)反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1,平衡常数为K1
FeO(s)+CO(g) ΔH1,平衡常数为K1
反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH2,平衡常数为K2在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2在不同温度时K1、K2的值如下表:
700 ℃ | 900 ℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
反应CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH,平衡常数K,则ΔH=___________(用ΔH1和ΔH2表示),K=___________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)
CO(g)+H2O(g) ΔH,平衡常数K,则ΔH=___________(用ΔH1和ΔH2表示),K=___________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是________反应(填“吸热”或“放热”)。
CO(g)+H2O(g)是________反应(填“吸热”或“放热”)。
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:
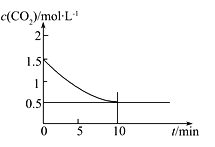
①该条件下反应的平衡常数为___________;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为____________mol·L-1。
②下列措施中能使平衡时![]() 增大的是__________(填序号) 。
增大的是__________(填序号) 。
A.升高温度 B.增大压强 C.再充入一定量的CO2 D.再加入一定量铁粉
③一定温度下,在一个固定容积的密闭容器中发生上述反应,下列能判断该反应达到化学平衡状态的是________(填字母)。
a.容器中的压强不变
b.气体的密度不再改变
c.v正(CO2)=v逆(CO)
d.c(CO2)=c(CO)
e.容器内气体总物质的量不变
【答案】(1)ΔH1-ΔH2 K1/K2 吸热(5分)
(2)①2.0 0.67(或2/3) ②A ③bc(5分)
【解析】(1)已知反应① Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1,平衡常数为K1
FeO(s)+CO(g) ΔH1,平衡常数为K1
反应② Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH2,平衡常数为K2
FeO(s)+H2(g) ΔH2,平衡常数为K2
根据盖斯定律可知①-②即得到反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的ΔH=ΔH1-ΔH2,平衡常数K=K1/K2;根据表中数据可知随温度的升高,K1增大,K2减小,所以K值随温度升高而增大,因此反应CO2(g)+H2(g)
CO(g)+H2O(g)的ΔH=ΔH1-ΔH2,平衡常数K=K1/K2;根据表中数据可知随温度的升高,K1增大,K2减小,所以K值随温度升高而增大,因此反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是吸热反应。
CO(g)+H2O(g)是吸热反应。
(2)①根据表中数据可知平衡时二氧化碳浓度是0.5mol/L,消耗二氧化碳浓度是1.0mol/L,因此生成CO浓度是1.0mol/L,则该条件下反应的平衡常数为![]() ;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,设平衡时CO2的浓度为xmol/L,则
;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,设平衡时CO2的浓度为xmol/L,则![]() ,解得x=
,解得x=![]() 。
。
②A.正反应吸热,升高温度平衡向正反应方向进行,则![]() 增大,A正确;B.反应前后体积不变,增大压强
增大,A正确;B.反应前后体积不变,增大压强![]() 不变,B错误;C.再充入一定量的CO2平衡常数不变,则
不变,B错误;C.再充入一定量的CO2平衡常数不变,则![]() 不变,C错误;D.再加入一定量铁粉,平衡不移动,
不变,C错误;D.再加入一定量铁粉,平衡不移动,![]() 不变,D错误,答案选A。
不变,D错误,答案选A。
③a. 反应前后体积不变,,则容器中的压强始终不变,a错误;b.反应前后气体的质量变化,容积不变,则气体的密度不再改变说明反应达到平衡状态,b正确;c. v正(CO2)=v逆(CO)表示反应速率方向相反,且满足反应速率之比是相应的化学计量数之比,说明反应达到平衡状态,c正确;d. c(CO2)=c(CO)没有指明反应的方向,则反应不一定达到平衡状态,d错误;e. 反应前后体积,则容器内气体总物质的量始终不变,不能说明反应达到平衡状态,e错误,答案选bc。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案【题目】地球表面十公里厚的地层中,含钛元素达千分之六,比铜多61倍,金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值。氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。以TiCl4为原料,经过一系,列反应可以制得Ti3N4和纳米TiO2(如下图)。

图中的M是短周期金属元素,M的部分电离能如下表:
I1 | I2 | I3 | I4 | I5 | |
电离能/(kJ·mol-1) | 738 | 1451 | 7733 | 10 540 | 13 630 |
请回答下列问题:
⑴TiO2为离子晶体,己知晶体中阳离子的配位数为6,阴离子的配位数为3,则阳离子的电子排布式为___________
⑵金属Ti与金属M的晶体原子堆积模式相同,其堆积模型为_________(填写堆积模型名称),晶体中原子在二维平面里的配位数为_____________
⑶室温下TiCl4为无色液体,沸点为136.4℃,由此可知其晶体类型为__________,构成该晶体的粒子的空间构型为_____________
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如下图所示,已知该氮化钛的密度为pg·cm-3,则该晶胞中N、Ti之间的最近距离为_____ pm,(NA为阿伏加德常数的数值,只列算式)。该晶体中与Ti原子距离相等且最近的Ti原子有___________个。

(5)科学家通过X射线探明KC1、MgO、CaO、TiN的晶体与NaCl的晶体结构相似。且知三种离子晶体的晶格能数据如下:
离子晶体 | NaCl | KC1 | CaO |
晶格能/(kJ·mol-1) | 786 | 715 | 3401 |
KC1、CaO、TiN三种离子晶体硬度由低到该的顺序为_____________
【题目】己知反应A(g) + B(g) ![]() C(g) + D(g)的平衡常数K值与温度的关系如下表所示。830℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
C(g) + D(g)的平衡常数K值与温度的关系如下表所示。830℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
温度/℃ | 700 | 830 | 1200 |
K值 | 1.7 | 1.0 | 0.4 |
A.反应初始至平衡,A的平均反应速率v(A) = 0.005 mol·L-1·s-1
B.增大压强,正、逆反应速率均加快
C.该反应正向为放热反应
D.升高温度,K值增大,平衡正向移动,达到平衡后,B的转化率为50%
【题目】X、Y、Z、P、Q、W、R、T是元素周期表短期中最常见的主族元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
X | 其某一种同位素,被用作相对原子质量的标准 |
Y | 其最高价氧化物对应水化物能与其气态氢化物发生化合反应 |
P | 是短周期中(除稀有气体外)原子半径最大的元素 |
Q | 存在质量数为25、中子数为13的核素 |
W | 位于周期表第13列 |
R | 与Z同族, 且最高价氧化物对应水化物的浓溶液常温下与W 单质会出现钝化现象 |
(1)W元素位于周期表第________周期______族;T离子的结构示意图为____________。
(2)将Q、Z、R的简单离子的半径从大到小排序___________(用离子符号表示);R、T两种元素的最高价氧化物对应水化物的酸(或碱)性由强到弱的顺序为__________(用化学式表示)。
(3) X、Y、Z三种元素的简单氢化物中,稳定性最强的化合物的电子式为_________,化合物P2R溶液在空气中长期放置,会和氧气反应生成与过氧化钠的结构相似的物质P2R2,其溶液显黄色,则P2R2的电子式为______________。
(4)根据下表中的信息,判断下列化合物固态时的晶体类型(填“离子晶体”……等)。
化合物 | x3Y4 | R2T2 |
主要物理性质 | 硬度可以和金刚石相媲美,熔点>3600℃ | 常温下是一种橙黄色液体,熔点为-76°C |
晶体类型 | ________ | _________ |
(5)Q的单质能与X、Z形成的某种化合物反应,写出其化学方程式:______________。
(6)X与Q形成的lmol化合物Q2X3与水反应,生成2molMg(OH)2和1mol某气态烃,该烃分子中碳氢质量比为9: 1,写出该气态烃的结构简式_______,并写出Q2X3与水反应的化学方程式________。
