题目内容
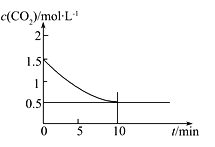
【题目】25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH的关系如下图所示。下列有关溶液中离子浓度关系叙述正确的是( )

A.W点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)
B.pH=4的溶液中:c(H2CO3)+c(HCO3-)+c(CO32-)<0.1mol·L-1
C.pH=8的溶液中:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-)+c(Cl-)
D.pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)>c(H2CO3)
【答案】B
【解析】A、W点所示的溶液呈电中性,即c(正电荷) = c(负电荷),则c(Na+) + c(H+) = 2 c(CO32-) + c(HCO3-) + c(OH-) + c(Cl-),不能漏了碳酸氢根离子所带负电荷浓度,A错误;B、由物料守恒原理可知,c(H2CO3) + c(HCO3-) + c(CO32-) + c(CO2) = 0.1 mol·L-1,由于饱和碳酸的pH=5.6,则pH = 4的溶液中已经逸出部分CO2,则c(H2CO3) + c(HCO3-) + c(CO32-) < 0.1 mol·L-1,B正确;C、由电荷守恒原理可得:c(Na+) + c(H+) = 2 c(CO32-) + c(HCO3-) + c(OH-) + c(Cl-),由物料守恒原理可得:c(Na+) = 2 c(H2CO3) + 2 c(HCO3-) + 2 c(CO32-),则2 c(H2CO3) + 2 c(HCO3-) + 2 c(CO32-) + c(H+) = 2 c(CO32-) + c(HCO3-) + c(OH-) + c(Cl-),即2 c(H2CO3) + c(HCO3-) + c(H+) = c(OH-) + c(Cl-),不能漏了H2CO3浓度的2倍,C错误;D、根据图像可知pH=11时,Na2CO3的浓度远远大于NaHCO3,说明反应Na2CO3+HCl=NaCl+NaHCO3中参加反应的Na2CO3较少,过量的Na2CO3较多,由过量的Na2CO3及等量NaCl、NaHCO3的电离及NaHCO3的水解规律可知,c(Na+) > c(CO32-) > c(Cl-) > c(HCO3- ) > c(H2CO3),D错误;答案选B。

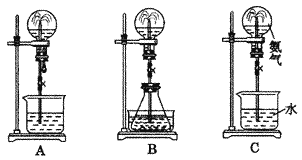
【题目】某化学兴趣小组用下面所示装置制取氯酸钾、次氯酸钠和氯水并进行探究实验。

实验I.制取氮酸钾、次氯酸钠和氯水
(1)写出装置A实验室制取Cl2的化学反应方程式________________________________。
(2)制取实验结束后,取出装置B中的试管,冷却结晶、过滤、洗涤,该实验操作过程需要的玻璃仪器有胶头滴管、烧杯、_________、_________。为提高氯酸钾和次氯酸钠的产率,在实验装置中还需要改进的是_________。
(3)装置 C 中反应需要在冰水浴中进行,其原因是________________________________。
(4)装置D中的实验现象是溶液先变红后褪色,最后又变为_________色。
实验Ⅱ 尾气处理
实验小组利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(5)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中的CO2的影响)
①提出合理假设
假设1:只存在SO32- ;假设2:既不存在SO32-也不存在ClO-;假设 3:_________。
②设计实验方案,进行实验。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:3mol/L H2SO4、1mol/LNaOH 溶液、0.01mol/L 酸性 KMnO4 溶液、淀粉 KI 溶液。
实验步骤 | 预期现象和结论 |
步骤1:取少量吸收液分置于A、B试管中 | |
步骤2:向A试管中滴加0.01mol/L酸性 | (1)若溶液褪色,则假设1成立 |
KMnO4溶液 | (2)若溶液不褪色,则假设2或3成立 |
步骤3:_____ | _____ |