题目内容
【题目】X、Y、Z、P、Q、W、R、T是元素周期表短期中最常见的主族元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
X | 其某一种同位素,被用作相对原子质量的标准 |
Y | 其最高价氧化物对应水化物能与其气态氢化物发生化合反应 |
P | 是短周期中(除稀有气体外)原子半径最大的元素 |
Q | 存在质量数为25、中子数为13的核素 |
W | 位于周期表第13列 |
R | 与Z同族, 且最高价氧化物对应水化物的浓溶液常温下与W 单质会出现钝化现象 |
(1)W元素位于周期表第________周期______族;T离子的结构示意图为____________。
(2)将Q、Z、R的简单离子的半径从大到小排序___________(用离子符号表示);R、T两种元素的最高价氧化物对应水化物的酸(或碱)性由强到弱的顺序为__________(用化学式表示)。
(3) X、Y、Z三种元素的简单氢化物中,稳定性最强的化合物的电子式为_________,化合物P2R溶液在空气中长期放置,会和氧气反应生成与过氧化钠的结构相似的物质P2R2,其溶液显黄色,则P2R2的电子式为______________。
(4)根据下表中的信息,判断下列化合物固态时的晶体类型(填“离子晶体”……等)。
化合物 | x3Y4 | R2T2 |
主要物理性质 | 硬度可以和金刚石相媲美,熔点>3600℃ | 常温下是一种橙黄色液体,熔点为-76°C |
晶体类型 | ________ | _________ |
(5)Q的单质能与X、Z形成的某种化合物反应,写出其化学方程式:______________。
(6)X与Q形成的lmol化合物Q2X3与水反应,生成2molMg(OH)2和1mol某气态烃,该烃分子中碳氢质量比为9: 1,写出该气态烃的结构简式_______,并写出Q2X3与水反应的化学方程式________。
【答案】 三 ⅢA 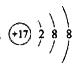 S2->O2->Mg2+ HClO4>H2SO4
S2->O2->Mg2+ HClO4>H2SO4 ![]()
![]() 原子晶体 分子晶体 【答题空10】2Mg+CO2
原子晶体 分子晶体 【答题空10】2Mg+CO2![]() 2MgO+C CH3C≡CH Mg2C3+4H2O=2Mg()+C3H4↑
2MgO+C CH3C≡CH Mg2C3+4H2O=2Mg()+C3H4↑
【解析】元素周期表短周期中的常见主族元素中,X元素的一种同位素可被用作相对原子质量的标准,则X为C元素;Y元素的最高价氧化物对应水化物能与其气态氢化物相互间发生化合反应,则Y为N元素;P是短周期中(除稀有气体外)原子半径最大的元素,则P为Na;Q存在质量数为25,中子数为13的核素,其质子数为25-13=12,则Q为Mg;W位于周期表第13列,原子序数大于Mg,故W为Al;R与Z同族,且最高价氧化物对应水化物的浓溶液常温下与W单质(Al)会出现钝化现象,则R为S元素,Z为O元素;T的原子序数最大,则T为Cl;
(1)Al元素的核电荷数为13,位于周期表第三周期ⅢA族;氯元素的核电荷数为17,Cl-的结构示意图为![]() ;
;
(2)Q、Z、R的简单离子分别为Mg2+、O2-、S2-,Mg2+、O2-是电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2->Mg2+,O2-离子结构比S2-少一个电子层,离子半径小,则离子半径的大小关系为:S2->O2->Mg2+;氯的非金属性比硫强,最高价氧化物对应水化物的酸(或碱)性由强到弱的顺序为HClO4>H2SO4;
(3) C、N、O三种元素中氧元素的非金属性最强,则简单氢化物中,稳定性最强的化合物为H2O,其电子式为![]() ;化合物Na2S溶液在空气中长期放置,与氧气反应会生成Na2S2,与过氧化钠的结构相似,则Na2S2的电子式为
;化合物Na2S溶液在空气中长期放置,与氧气反应会生成Na2S2,与过氧化钠的结构相似,则Na2S2的电子式为![]() ;
;
(4)X3Y4的熔点高于3600℃,熔点很高,属于原子晶体,R2T2的熔点为-76℃,熔点很低,属于分子晶体;
(5)Mg能在CO2中燃烧,生成氧化镁和碳,其反应化学方程式为2Mg+CO2![]() 2MgO+C;
2MgO+C;
(6)该烃分子中碳氢质量比为9:1,C、H的物质的量之比为=3∶4,根据“碳与镁生成的1mol化合物Q与水反应生成2mol Mg(OH)2和1mol烃”可知该烃的分子式为C3H4;Q的化学式为Mg2C3,Mg2C3与水反应生成氢氧化镁和C3H4,结构简式为CH3C≡CH;反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑;

 阅读快车系列答案
阅读快车系列答案【题目】下表为元素周期表的一部分,用元素符号或化学式回答下列问题。
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(1)10种元素中,化学性质最不活泼的是_________,除⑩外原子半径最大的是________。
(2)①③⑤三种元素最高价氧化物对应的水化物碱性最强的是__________ ;⑧⑨形成氢化物的稳定性由强到弱顺序为_________________。
(3)①②③⑤⑧五种元素形成的离子半径由大到小的顺序为______________________
(4)元素⑥的名称是____;元素④的原子结构示意图是/span>_______;元素⑦的氢化物和元素①单质反应的化学方程式为________________。
(5)①⑨形成的化合物灼烧时火焰焰色为________;该化合物的溶液与元素⑧的单质反应的化学方程式为_______________________。
(6)①、⑤和⑧最高价氧化物对应的水化物之间两两相互反应的离子方程式为____________________。
(7)元素③的单质在元素⑥⑦形成的某化合物中燃烧的化学方程式为____________________。