题目内容
【题目】实验室里,从废旧钴酸锂离子电池的正极材料(在铝箔上涂覆活性物质LiCoO2)中,回收钴、锂的操作流程如下图所示:

回答下列问题。
(1)拆解废旧电池获取正极材料前,先将其浸入NaCl溶液中,使电池短路而放电,此时溶液温度升高,该过程中能量的主要转化方式为____。
(2)“碱浸”过程中产生的气体是____;“过滤”所得滤液用盐酸处理可得到氢氧化铝,反应的化学方程式为____。
(3)“酸浸”时主要反应的离子方程式为____;若硫酸、Na2S2O3溶液用一定浓度的盐酸替代,也可以达到“酸浸”的目的,但会产生____(填化学式)污染环境。
(4)“沉钴”时,调pH所用的试剂是____;“沉钴”后溶液中c(Co2+)=____。(已知:Ksp[Co(OH)2]=1.09×l0-15)
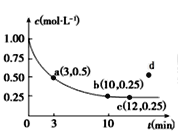
(5)在空气中加热Co(OH)2,使其转化为钴的氧化物。加热过程中,固体质量与温度的关系如左下图所示。290~500℃,发生反应的化学方程式为____。
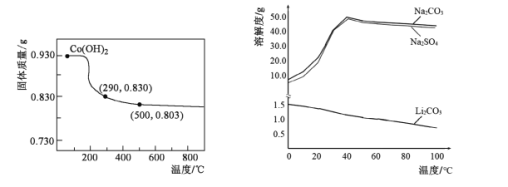
(6)根据右下图判断,“沉锂”中获得Li2CO3固体的操作主要包括____、____、洗涤、干燥等步骤。
【答案】化学能→电能→热能 H2 NaAlO2+HCl+H2O=NaCl+Al(OH)3↓ 8LiCoO2+ S2O32-+22H+=8Li++8Co2++2SO42-+11H2O Cl2 NaOH溶液或氢氧化钠固体 1.09×l0-6mol/L 6Co2O3![]() 4Co3O4+ O2↑ 蒸发浓缩 趁热过滤
4Co3O4+ O2↑ 蒸发浓缩 趁热过滤
【解析】
正极材料主要由Al和LiCoO2组成,LiCoO2属于盐类,由复分解反应的条件可判断,其与NaOH溶液混合不发生反应,故“碱浸”过程中只有Al和NaOH反应生成偏铝酸钠和氢气,过滤得到滤渣为LiCoO2;“酸浸”时反应物有LiCoO2、硫酸和Na2S2O3溶液,依据“沉钴”产物为Co(OH)2可判断,反应后钴元素的价态从+3价降为+2价,依据氧化还原反应规律以及工艺中最后还可获得Na2SO4·10H2O副产品,可推知S元素价态升高并转化为SO42-;之后调节pH值得到Co(OH)2沉淀,再加入碳酸钠溶液调节pH值沉锂,得到碳酸锂和母液,母液结晶得到Na2SO4·10H2O。
(1)依据“电池短路而放电”“溶液温度升高”两项信息,即可判断废旧电池的处理过程中能量的主要转化方式为化学能→电能→热能;
(2)依题中信息可知,正极材料主要由Al和LiCoO2组成,LiCoO2属于盐类,由复分解反应的条件可判断,其与NaOH溶液混合不发生反应,故“碱浸”过程中只有Al和NaOH反应,生成NaAlO2和H2;“过滤”所得滤液用适量盐酸处理可以得到氢氧化铝,方程式为NaAlO2+HCl+H2O=NaCl+Al(OH)3↓;
(3)根据分析可知“酸浸”时Na2S2O3被氧化为SO42-,Co元素被还原,结合电子守恒和元素守恒可知离子反应方程式为:8LiCoO2+ S2O32-+22H+=8Li++8Co2++2SO42-+11H2O;加入的Na2S2O3 起还原作用,用一定浓度的盐酸替代“Na2S2O3溶液和硫酸”,也能实现酸浸目的,可知该反应中,盐酸也起了还原剂的作用,氧化产物为会污染环境的Cl2;
(4)结合“沉锂”后母液中还可以获得Na2SO4·10H2O,可知用的试剂为NaOH溶液或固体;溶液pH=9.5,则溶液中c(OH-)=10-4.5mol/L,带入Ksp[Co(OH)2]= c2(OH-)·c(Co2+)=1.09 ×l0-15求得c(Co2+)=1.09×l0-6mol/L;
(5)从图中信息可知,加热前的反应物为Co(OH)2 (0.930g) ,其物质的量为0.01mol,依据钴元素的量不变可知: n(Co)=0.01 mol, m(Co)=0.590g,温度升温290℃时,转化为0.830g某种钴的氧化物,该氧化物中,n(O)=![]() =0.015mol,由此可以确定该氧化物为Co2O3;同理可以确定500℃时,n(O)=
=0.015mol,由此可以确定该氧化物为Co2O3;同理可以确定500℃时,n(O)=![]() ≈0.0133mol,则生成的氧化物为Co3O4;所以290℃~500℃过程中,Co2O3转化为Co3O4,反应过程中,Co元素化合价降低。氧元素化合价升高并转化为O2,故反应的化学方程式为6Co2O3
≈0.0133mol,则生成的氧化物为Co3O4;所以290℃~500℃过程中,Co2O3转化为Co3O4,反应过程中,Co元素化合价降低。氧元素化合价升高并转化为O2,故反应的化学方程式为6Co2O3![]() 4Co3O4+ O2↑;
4Co3O4+ O2↑;
(6)分析溶解度曲线可知LiCO3微溶,其溶解度随温度升高而降低,为了提高锂元素的回收率,同时防止硫酸钠析出,应采用蒸发浓缩(减少溶剂)并在较高温度下趁热过滤等操作。

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案【题目】根据下列实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 实验结论 |
A | 向0.1mol/L碳酸钠溶液中滴入酚酞,溶液变红,加热,红色加深。 | 碳酸钠属于弱碱 |
B | 测定醋酸溶液pH,用玻璃棒蘸取溶液,点在pH试纸上,试纸显红色。 | 醋酸溶液显酸性 |
C | 将铜片和锌片用导线相连,插入CuSO4溶液中,锌片质量减小,铜片质量增加。 | 锌被还原 |
D | 向氯化银的浊液中滴入KI溶液,浊液中的固体由白色变为黄色。 | Ksp(AgCl)<Ksp(AgI) |
A.AB.BC.CD.D
【题目】硫及其化合物对人类的生产和生活有着重要的作用.
2SO2(g)+O2(g)2SO3(g)△H=﹣198kJmol﹣1是制备硫酸的重要反应.
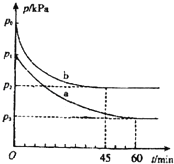
(1)在容积为V L的密闭容器中起始充入2mol SO2和1mol O2,反应在不同条件下进行,反应体系总压强随时间的变化如图所示.与实验a相比,实验b改变的条件是 ,判断的依据 .
(2)二氧化硫在一定条件下还可以发生如下反应:
SO2(g)+NO2(g)SO3(g)+NO(g)△H=﹣42kJmol﹣1.
在1L恒容密闭容器中充入SO2(g)和NO2(g),所得实验数据如下:
实验编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
N(SO2) | N(NO2) | N(NO) | ||
甲 | T1 | 0.80 | 0.20 | 0.18 |
乙 | T2 | 0.20 | 0.80 | 0.16 |
丙 | T3 | 0.20 | 0.30 | a |
①实验甲中,若2min时测得放出的热量是4.2kJ,则0~2min时间内,用SO2(g)表示的平均反应速率v(SO2)= ,该温度下的平衡常数 .
②实验丙中,达到平衡时,NO2的转化率为 .
③由表中数据可推知,Tl T2(填“>”“<’’或“=”),判断的理由是 .