题目内容
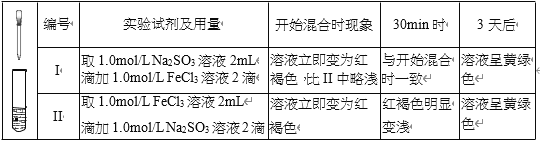
【题目】某实验小组研究 FeCl3 溶液与 Na2SO3 溶液之间的反应,进行如下实验探究
(1)配制 FeCl3 溶液时,先将 FeCl3 溶于浓盐酸,再稀释至指定浓度。结合化学用语说 明浓盐酸的作用:______。
(2)甲同学认为,上述实验在开始混合时观察到的现象不涉及氧化还原反应,实验 I中红褐色比 II 中略浅的原因是______。
(3)乙同学认为实验 II 可能发生了氧化还原反应,为了探究反应的产物做了实验 III和生成物检验。

① 取少量 Na2SO3 溶液电极附近的混合液,加入______,产生白色沉淀,证明产生了 SO42-。
② 该同学又设计实验探究另一电极的产物,取少量FeCl3溶液电极附近的混合液,加入铁氰化钾溶液,产生____________________,证明产生了Fe2+。
(4)实验 III 发生反应的方程式是______。
(5)实验小组查阅资料:溶液中 Fe3+、 SO32-、OH-三种微粒会形成红色配合物并存在如下转化:
![]()
从反应速率和化学平衡两个角度解释实验 I、II 现象背后的原因可能是:______。
【答案】Fe3++3H2O![]() Fe(OH)3+3H+;盐酸抑制氯化铁水解 Fe3+起始浓度小,水解出的Fe(OH)3少 足量盐酸和BaCl2溶液 蓝色沉淀 2Fe3+ + SO32- + H2O
Fe(OH)3+3H+;盐酸抑制氯化铁水解 Fe3+起始浓度小,水解出的Fe(OH)3少 足量盐酸和BaCl2溶液 蓝色沉淀 2Fe3+ + SO32- + H2O ![]() 2Fe2+ + SO42-+ 2H+ 生成红色配合物的反应速率快,红色配合物生成橙色配合物的速率较慢;在O2的作用下,橙色的HOFeOSO2浓度下降,平衡不断正向移动,有浅绿色的Fe2+生成
2Fe2+ + SO42-+ 2H+ 生成红色配合物的反应速率快,红色配合物生成橙色配合物的速率较慢;在O2的作用下,橙色的HOFeOSO2浓度下降,平衡不断正向移动,有浅绿色的Fe2+生成
【解析】
(1)FeCl3 溶液中存在Fe3+水解平衡,Fe3++3H2O![]() Fe(OH)3+3H+,加入浓盐酸可以抑制其水解。
Fe(OH)3+3H+,加入浓盐酸可以抑制其水解。
(2)实验Ⅰ中1.0mol/L FeCl3溶液2滴,实验Ⅱ中1.0mol/L FeCl3溶液2mL,实验I相对于实验Ⅱ,Fe3+起始浓度小,水解出的Fe(OH)3少。
(3)①加入足量盐酸和BaCl2溶液,产生白色沉淀,证明SO42-。
②加入铁氰化钾溶液,产生蓝色沉淀,证明Fe2+。
(4)由(3)可知,Fe3+与 SO32-发生氧化还原反应生成Fe2+ 和SO42-。
(5)1![]() 30min的实验现象溶液立即变为红褐色,随后变浅,可见生成红色配合物的反应速率快,红色配合物生成橙色配合物的反应速率慢,是因为在氧气的作用下,c(HOFeOSO2)减小,
30min的实验现象溶液立即变为红褐色,随后变浅,可见生成红色配合物的反应速率快,红色配合物生成橙色配合物的反应速率慢,是因为在氧气的作用下,c(HOFeOSO2)减小,![]() ,平衡不断正向移动,有浅绿色的Fe2+生成,
,平衡不断正向移动,有浅绿色的Fe2+生成,
(1)配制 FeCl3 溶液时,Fe3+会水解,Fe3++3H2O![]() Fe(OH)3+3H+,加入浓盐酸可以抑制其水解,故答案为:Fe3++3H2O
Fe(OH)3+3H+,加入浓盐酸可以抑制其水解,故答案为:Fe3++3H2O![]() Fe(OH)3+3H+,盐酸抑制氯化铁水解。
Fe(OH)3+3H+,盐酸抑制氯化铁水解。
(2)实验Ⅰ中1.0mol/L FeCl3溶液2滴,实验Ⅱ中1.0mol/L FeCl3溶液2mL,实验I相对于实验Ⅱ,Fe3+起始浓度小,虽然越稀越水解,但水解的铁离子数目不及实验Ⅱ,且水解的速率不及实验Ⅱ,水解出的Fe(OH)3少,所以开始混合时,实验I中红褐色比Ⅱ中略浅,故答案为:Fe3+起始浓度小,水解出的Fe(OH)3少。
(3)①要证明产生了的SO42-,应加入足量盐酸和BaCl2溶液,产生白色沉淀,证明产生了 SO42-,故答案为:足量盐酸和BaCl2溶液。
②要证明Fe3+发生还原反应生成了Fe2+,加入铁氰化钾溶液,产生蓝色沉淀,证明产生了Fe2+,故答案为:蓝色沉淀。
(4)由(3)可知,Fe3+与 SO32-发生氧化还原反应生成Fe2+ 和SO42-,化学反应方程式为:2Fe3+ + SO32- + H2O=2Fe2+ + SO42-+ 2H+,故答案为:2Fe3+ + SO32- + H2O=2Fe2+ + SO42-+ 2H+。
(5)1![]() 30min的实验现象溶液立即变为红褐色,随后变浅,可见生成红色配合物的反应速率快,红色配合物生成橙色配合物的反应速率慢,是因为在氧气的作用下,c(HOFeOSO2)减小,
30min的实验现象溶液立即变为红褐色,随后变浅,可见生成红色配合物的反应速率快,红色配合物生成橙色配合物的反应速率慢,是因为在氧气的作用下,c(HOFeOSO2)减小,![]() ,平衡不断正向移动,有浅绿色的Fe2+生成,故答案为:生成红色配合物的反应速率快,红色配合物生成橙色配合物的速率较慢,在O2的作用下,橙色的HOFeOSO2浓度下降,平衡不断正向移动,有浅绿色的Fe2+生成。
,平衡不断正向移动,有浅绿色的Fe2+生成,故答案为:生成红色配合物的反应速率快,红色配合物生成橙色配合物的速率较慢,在O2的作用下,橙色的HOFeOSO2浓度下降,平衡不断正向移动,有浅绿色的Fe2+生成。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案