题目内容
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ?ΔH =+49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ?ΔH=-192.9 kJ/mol
根据上述反应,下列说法正确的是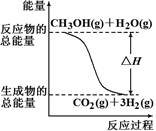
| A.反应①中的能量变化如上图所示 |
| B.可推知2H2(g)+O2(g)=2H2O(g)?ΔH=-483.8 kJ/mol |
| C.1 mol CH3OH充分燃烧放出的热量为192.9 kJ |
| D.CH3OH转变成H2的过程一定要吸收能量 |
B
解析试题分析:A. 反应①是吸热反应,即生成物的能量比反应物的能量高,所以反应①中的能量变化不能用如上图所示,错误;B.(②-①)×2整理可得2H2(g)+O2(g)=2H2O(g) ?ΔH=-483.8 kJ/mol,正确;C. 由于氢气燃烧还会放出大量的热量,所以1 mol CH3OH充分燃烧放出的热量大于192.9 kJ,错误;D.在上述两个反应中都是甲醇转化为氢气的反应,一个是放热反应,一个是吸热反应, 因此CH3OH转变成H2的过程不一定要吸收能量,错误。
考点:考查甲醇蒸气转化为氢气的反应原理的知识。

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
只含非金属元素的晶体描述正确的是
| A.有可能是金属晶体 | B.有可能是离子晶体 |
| C.一定是分子晶体 | D.一定不是原子晶体 |
下列能源中属于二次能源的是( )
| A.天然气 | B.电力 | C.原煤 | D.石油 |
已知化学反应2C(s)+O2(g) ="==" 2CO(g)、2CO(g)+O2(g) ===2CO2(g)都是放热反应。据此判断,下列说法不正确的是(其他条件相同)( )。
| A.12 g C所具有的能量一定高于28 g CO所具有的能量 |
| B.56 g CO和32 g O2所具有的总能量大于88 g CO2所具有的总能量 |
| C.12 g C和32 g O2所具有的总能量大于44 g CO2所具有的总能量 |
| D.将一定质量的C燃烧,生成CO2比生成CO时放出的热量多 |
已知25 ℃、101 kPa下,含1 mol碳原子的石墨完全燃烧生成CO2放出热量393.51 kJ;含1 mol碳原子的金刚石完全燃烧生成CO2放出395.41 kJ的热量。据此判断,下列说法正确的是( )
| A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低 |
| B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高 |
| C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低 |
| D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高 |
下列叙述正确的是
A.在0.10 mol·L-1 NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)+c(CO ) ) |
| B.甲烷的标准燃烧热是890.3 kJ·mol-1,则甲烷燃烧的热化学方程式是: CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3 kJ·mol-1 |
| C.用铜作电极电解CuSO4溶液:2Cu2++2H2O 电解 2Cu+O2↑+4H+ |
| D.以KOH为电解质溶液的甲醇燃料电池的负极电极反应式: |
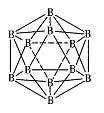 ③单分子A1Cl3的立体构型是 ,缔合双分子Al2Cl6中Al原子的轨道杂化类型是 。
③单分子A1Cl3的立体构型是 ,缔合双分子Al2Cl6中Al原子的轨道杂化类型是 。