题目内容
【题目】目前的锂离子电池的正极材料多是LiCoO2、LiMn2O4、LiFePO4和双离子传递型聚合物等。改良正极材料的性能是锂离子电池领域的重点方向,如用碳包覆LiFePO4和向其中掺杂金属银等。下列过程是制备该正极材料的流程图:
![]()
回答下列问题:
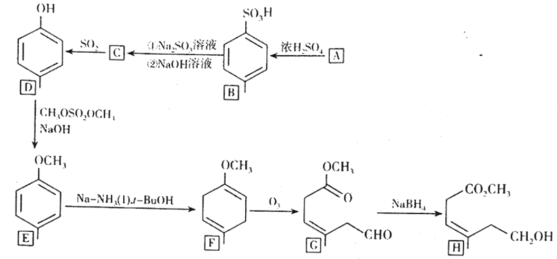
(1)LiFePO4中铁元素的化合价为_____价。已知原料是Li2CO3、FeC2O4·2H2O、NH4H2PO4和C6H12O6的混合物,其中Li、Fe、P三种元素的物质的量比为1:1:1,C6H12O6的用量占原料总质量的5%。若原料的质量为1000 g,则需要称取NH4H2PO4的质量为_______(保留两位小数)。
(2)将原料先行研磨4 h目的是_________。为了更快得到前驱体粉末,除了保持温度在50℃外,还应进行的常见操作方法是_________。
(3)两次焙烧均需要在高纯氮气环境下进行,原因是________。葡萄糖分解产生的碳除了提供还原性环境,提高产物纯度,而且可以阻止晶粒的聚集长大,控制颗粒形状,提高LiFePO4的电导率。则葡萄糖分解的化学反应方程式(分解过程中只有C一种单质生成)为________。600℃加热时硝酸银发生分解生成红棕色气体和3种常见单质(其中两种气体单质物质的量比为2:7),则分解时的化学反应方程式为_______。
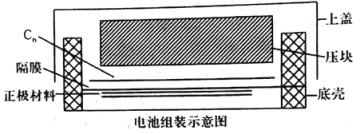
(4)如图所示是用LiFePO4/Ag/C作正极材料制成的纽扣锂离子电池组装示意图。充电时,其正、负极材料所发生反应的电极方程式分别是______、______(锂离子电池是靠xLi+在两极的嵌入和嵌出进行工作)。
【答案】+2 328.90g~329.07g之间 粉碎原料,增强后续过程中的焙烧效果 不断搅拌 防止碳的燃烧和+2价铁的氧化 C6H12O6![]() 6C+6H2O 6AgNO3
6C+6H2O 6AgNO3![]() 6Ag+2N2↑+7O2↑+2NO2↑ LiFePO4=xLi++Li1-xFePO4+xe- xLi++xe-+C6=LixC6(或Li++e-=Li等)
6Ag+2N2↑+7O2↑+2NO2↑ LiFePO4=xLi++Li1-xFePO4+xe- xLi++xe-+C6=LixC6(或Li++e-=Li等)
【解析】
(1)根据化合物中元素化合价代数和等于0,结合常见元素或原子团化合价确定Fe元素化合价;根据元素的物质的量的比,推断相应物质的物质的量的比及质量比,最后再根据总质量计算需要NH4H2PO4的质量;
(2)从固体与液体物质充分接触,提高接触面积对反应速率的影响分析;
(3)根据空气中的氧气有强氧化性分析;根据元素守恒,结合题目已知信息书写反应方程式;600℃加热时AgNO3发生分解生成红棕色气体是NO2,三种单质为Ag、N2、O2,其中两种气体单质的物质的量比为2:7,结合电子守恒分析可得分解时的化学反应方程式;
(4)充电时,正极连接电源正极为阳极,失去电子,发生氧化反应,负极连接电源负极为阴极,得到电子,发生还原反应,据此书写电极上所发生反应的电极反应式。
(1)在LiFePO4中,Li化合价为+1价,PO43-化合价为-3价,根据化合物中所有元素化合价代数和等于0,可知铁元素的化合价为+2价。已知原料是Li2CO3、FeC2O4·2H2O、NH4H2PO4和C6H12O6的混合物,其中Li、Fe、P三种元素的物质的量比为1:1:1,则根据物质含有的Li、Fe、P三种元素的原子守恒,可知Li2CO3、FeC2O4·2H2O、NH4H2PO4的物质的量的比是1:2:2,三种物质混合时质量比是37:180:115,由于C6H12O6的用量占原料总质量的5%,设其中含有葡萄糖质量为x,则![]() ×100%=5%,解得x=17.5 g,此时总质量m(总)=(x+37+180+115)g=349.5 g,其中NH4H2PO4的含量为:
×100%=5%,解得x=17.5 g,此时总质量m(总)=(x+37+180+115)g=349.5 g,其中NH4H2PO4的含量为:![]() ×100%=32.9%。若原料的质量为1000 g,则需要称取NH4H2PO4的质量m=1000 g×32.9%=329.00 g。
×100%=32.9%。若原料的质量为1000 g,则需要称取NH4H2PO4的质量m=1000 g×32.9%=329.00 g。
(2)将原料先行研磨4 h目的是粉碎原料,扩大固体的接触面积,增大反应速率,以增强后续过程中的焙烧效果。为了更快得到前驱体粉末,除了保持温度在50℃外,还进行的常见操作方法是搅拌;
(3)两次焙烧均需要在高纯氮气环境下进行,这是由于空气中含有的氧气具有强的氧化性,会将+2价的Fe氧化变为+3价,同时会使分解产生的C单质燃烧。在氮气环境,就可以防止碳的燃烧和+2价铁的氧化;葡萄糖受热分解产生C、H2O,反应方程式为:C6H12O6![]() 6C+6H2O;在600℃加热时AgNO3发生分解生成红棕色气体是NO2,同时还产生了三种常见单质Ag、N2、O2,其中两种气体单质N2、O2物质的量比为2:7,则根据电子守恒、原子守恒,可得该分解时的化学反应方程式为:6AgNO3
6C+6H2O;在600℃加热时AgNO3发生分解生成红棕色气体是NO2,同时还产生了三种常见单质Ag、N2、O2,其中两种气体单质N2、O2物质的量比为2:7,则根据电子守恒、原子守恒,可得该分解时的化学反应方程式为:6AgNO3![]() 6Ag+2N2↑+7O2↑+2NO2↑;
6Ag+2N2↑+7O2↑+2NO2↑;
(4)根据如图所示可知:充电时,电池正极连接电源正极,作阳极,失去电子,发生氧化反应,阳极的电极反应式为:LiFePO4-xe =xLi++Li1-xFePO4 -或写为LiFePO4=xLi++Li1-xFePO4+xe-;电池负极连接电源负极,作阴极,阴极上得到电子,发生还原反应,则阴极的电极反应式为:xLi++xe-+C6=LixC6(或Li++e-=Li等)。