题目内容
已知分解1 mol H2O2 放出热量98KJ,在含少量I-的溶液中,H2O2的分解机理为:
H2O2+ I- →H2O +IO- 慢 H2O2+ IO-→H2O +O2+ I- 快
下列有关反应的说法正确的是( )
| A.反应的速率与I-的浓度有关 | B.IO-也是该反应的催化剂 |
| C.反应活化能等于98KJ·mol-1 | D.v(H2O2)=v(H2O)=v(O2) |
A
解析试题分析:根据反应机理可知I-是H2O2分解的催化剂,碘离子浓度大,产生的IO-就多反应速率就快。因A正确,B错误。C、反应的活化能是反应物的总能量与生成物的总能量的差值。这与反应的物质得到多少,错误。D、 H2O2分解的总方程式是2H2O2= 2H2O+ O2↑。由于水是纯液体,不能用来表示反应速率,而且H2O2和O2的系数不同,表示的化学反应速率也不同。错误。
考点:考查H2O2分解的原理、影响化学反应速率的因素及相应的关系的知识。

练习册系列答案
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案
相关题目
把下列4种Na2S2O3溶液和相应体积的水,分别加入4个盛有20 mL 2 mol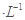 硫酸的烧杯中,此时,Na2S2O3和H2SO4缓慢地进行反应:
硫酸的烧杯中,此时,Na2S2O3和H2SO4缓慢地进行反应: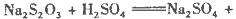
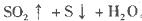 其中最早出现明显浑浊的是
其中最早出现明显浑浊的是
A.25 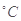 .20 mL 3 mol .20 mL 3 mol 的Na2S2O3溶液,25 mL蒸馏水 的Na2S2O3溶液,25 mL蒸馏水 |
B.0  .30 mL 2 mol .30 mL 2 mol 的Na2S2O3溶液,15 mL蒸馏水 的Na2S2O3溶液,15 mL蒸馏水 |
C.25  .10 mL 4 mol .10 mL 4 mol 的Na2S2O3溶液,35 mL蒸馏水 的Na2S2O3溶液,35 mL蒸馏水 |
D.0  .10 mL 2mol .10 mL 2mol 的Na2S2O3溶液,35 mL蒸馏水 的Na2S2O3溶液,35 mL蒸馏水 |
下列对“化学反应速率”的理解正确的是
| A.化学反应速率表示的是化学反应进行的限度 |
| B.化学反应速率可以用单位时间内反应物浓度的减少量来表示 |
| C.对于任何化学反应来说,反应速率越快,反应现象就越明显 |
| D.化学反应速率可以是正值,也可以是负值 |
在一不可变容器中发生如下反应:2NO2 2NO + O2 ΔH >0 达到平衡后,升温,混合气体的( )不变
2NO + O2 ΔH >0 达到平衡后,升温,混合气体的( )不变
| A.密度 | B.颜色 | C.压强 | D.总物质的量 |
工业制硫酸中的一步重要反应是SO2在400-500℃下的催化氧化,2SO2(g)+O2(g) 2SO3(g),这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是
2SO3(g),这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是
| A.达到平衡时,SO2的浓度与SO3的浓度相等 |
B.相同状况下,反应2SO3(g)  2SO2(g)+O2(g)是一个吸热反应 2SO2(g)+O2(g)是一个吸热反应 |
| C.为了提高SO2转化率,可适当提高O2浓度 |
| D.升高温度,放热反应的速率增大,吸热反应的速率也增大 |
为探究锌与稀硫酸的反应速率(以v(H2)表示),向反应混合液中加入某些物质,下列判断正确的是
| A.加入NH4HSO4固体,v(H2)增大 | B.加入少量水,v(H2)不变 |
| C.加入CH3COONa固体,v(H2)减小 | D.滴加少量CuSO4溶液,v(H2)减小 |
下列说法正确的是( )
| A.增大压强,化学反应速率一定增大 |
| B.化学反应速率为反应时间内反应物浓度的增加或者生成物浓度的减少 |
| C.升高温度,化学反应速率一定增大 |
| D.加入反应物,化学反应速率增大 |
可以充分说明反应P(g)+Q(g) R(g)+S(g)在恒温下已达到平衡的是( )
R(g)+S(g)在恒温下已达到平衡的是( )
| A.反应容器内的压强不随时间改变 | B.反应容器内P、Q、R、S四者共存 |
| C.P的生成速率和S的生成速率相等 | D.反应容器内的气体总物质的量不随时间变化 |