题目内容
已知NO2与N2O4可相互转化:2NO2(g)?N2O4(g);ΔH=-24.2 kJ/mol,在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2 L的密闭容器中,其中物质的浓度随时间变化的关系如下图所示。下列推理分析合理的是( )
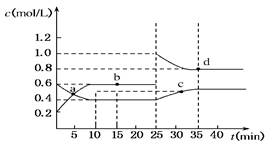

| A.反应进行到10 min时,体系吸收的热量为9.68 kJ |
| B.前10 min内,用v(NO2)表示的反应速率为0.02 mol/(L·min) |
| C.a、b、c、d四点中v正与v逆均相等 |
| D.25 min时,导致平衡移动的原因是升温 |
A
根据反应方程式可以得出在相同的时间内NO2的浓度变化量较大,是N2O4的浓度变化量的2倍。由图可知在前10min内上升的曲线表示的浓度变化较大所以上升的曲线是NO2的浓度,下降的曲线表示N2O4的浓度,则前10min的反应是逆向进行,反应的量为N2O4的物质的量为0.2ⅹ2=0.4mol,根据热化学方程式可以计算吸热为24.2ⅹ0.4="9.68" kJ,A正确;前10 min内,用v(NO2)表示的反应速率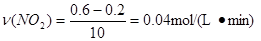 ,B错误;b、d两点表示的浓度不发生变化达到平衡v正与v逆均相等,而a、c两点表示的浓度处于变化中没有达到平衡所以衡v正与v逆均不相等,C错;25 min时,由图可知d曲线是NO2的浓度,c曲线是N2O4的浓度,则25min时平衡向正方向移动,若升温则平衡向吸热方向逆向移动,与前面分析相矛盾,D错误;答案选A。
,B错误;b、d两点表示的浓度不发生变化达到平衡v正与v逆均相等,而a、c两点表示的浓度处于变化中没有达到平衡所以衡v正与v逆均不相等,C错;25 min时,由图可知d曲线是NO2的浓度,c曲线是N2O4的浓度,则25min时平衡向正方向移动,若升温则平衡向吸热方向逆向移动,与前面分析相矛盾,D错误;答案选A。
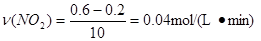 ,B错误;b、d两点表示的浓度不发生变化达到平衡v正与v逆均相等,而a、c两点表示的浓度处于变化中没有达到平衡所以衡v正与v逆均不相等,C错;25 min时,由图可知d曲线是NO2的浓度,c曲线是N2O4的浓度,则25min时平衡向正方向移动,若升温则平衡向吸热方向逆向移动,与前面分析相矛盾,D错误;答案选A。
,B错误;b、d两点表示的浓度不发生变化达到平衡v正与v逆均相等,而a、c两点表示的浓度处于变化中没有达到平衡所以衡v正与v逆均不相等,C错;25 min时,由图可知d曲线是NO2的浓度,c曲线是N2O4的浓度,则25min时平衡向正方向移动,若升温则平衡向吸热方向逆向移动,与前面分析相矛盾,D错误;答案选A。
练习册系列答案
相关题目
 2SO3。平衡时SO3为amol;在相同温度下按下列配比在VL密闭容器中放入起始物质,平衡时有关SO3的正确叙述是
2SO3。平衡时SO3为amol;在相同温度下按下列配比在VL密闭容器中放入起始物质,平衡时有关SO3的正确叙述是 N2O4(g) ,平衡后,向容器内再充入1mol N2O4(g),下列说法正确的( )
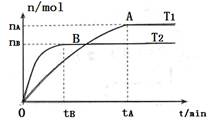
N2O4(g) ,平衡后,向容器内再充入1mol N2O4(g),下列说法正确的( ) 2NH3(g),在673K、30Mpa下,n(NH3)和n(H2)随时间变化的关系如右图所示,下列叙述正确的是( )
2NH3(g),在673K、30Mpa下,n(NH3)和n(H2)随时间变化的关系如右图所示,下列叙述正确的是( )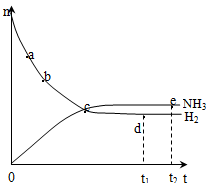
 CH3OH
CH3OH
 CH3OH(g)的平衡常数为 ;10min后,容器内的压强变为原来的 倍;改变下列条件,能提高CO转化率的是 。
CH3OH(g)的平衡常数为 ;10min后,容器内的压强变为原来的 倍;改变下列条件,能提高CO转化率的是 。 2/3Fe(s)+CO2(g)
2/3Fe(s)+CO2(g)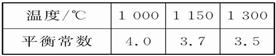
 C(s)+H2O(g) CO(g)+H2(g) △H=+131.5kJ·mol-1
C(s)+H2O(g) CO(g)+H2(g) △H=+131.5kJ·mol-1 ③又知C(s)+CO2(g) 2CO(g) △H=+172.5kJ·mol-1
③又知C(s)+CO2(g) 2CO(g) △H=+172.5kJ·mol-1
 N2O4(g) ,平衡后,向容器内再充入1molNO2,下列说法正确的( )
N2O4(g) ,平衡后,向容器内再充入1molNO2,下列说法正确的( )