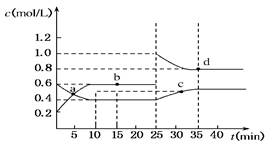
题目内容
在VL密闭容器中,通入0.2mol SO2和0.2mol SO3气体,在一定条件下发生反应:2SO2+O2 2SO3。平衡时SO3为amol;在相同温度下按下列配比在VL密闭容器中放入起始物质,平衡时有关SO3的正确叙述是
2SO3。平衡时SO3为amol;在相同温度下按下列配比在VL密闭容器中放入起始物质,平衡时有关SO3的正确叙述是
 2SO3。平衡时SO3为amol;在相同温度下按下列配比在VL密闭容器中放入起始物质,平衡时有关SO3的正确叙述是
2SO3。平衡时SO3为amol;在相同温度下按下列配比在VL密闭容器中放入起始物质,平衡时有关SO3的正确叙述是| A.放入0.2mol SO2、0.1molO2、0.1mol SO3,达到平衡时SO3必小于amol |
| B.放入0.2mol SO2、0.1molO2、0.2mol SO3,达到平衡时SO3必小于amol |
| C.放入0.4mol SO2、0.1molO2,达到平衡时SO3会等于0.4mol |
| D.放入0.2mol SO2、0.1molO2,达到平衡时SO3必小于amol |
D
在等温等容下要使平衡等效,就必须满足起始物质的量相等。起始物质相当于0.4mol SO2、0.1molO2,A中相当于0.3mol SO2、0.15molO2,和最初相比,相当于增大了氧气的浓度,提高二氧化硫的转化率,因此平衡时SO3不一定小于amol。B中相当于0.4mol SO2、0.2molO2,因此平衡时SO3必大于amol。因为反应是可逆反应,因此平衡时SO3不可能等于0.4mol。D相当于从原平衡体系中抽出0.2mol SO2,平衡向逆反应方向移动,所以答案D正确。

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
 C(g) +D(g);△H>0。在相同温度下反应达到平衡,活塞移动到4处。下列有关说法正确的是( )
C(g) +D(g);△H>0。在相同温度下反应达到平衡,活塞移动到4处。下列有关说法正确的是( )
 xC(g)+2D(g),5 min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1 mol/(L·min),下列结论错误的是 ( )
xC(g)+2D(g),5 min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1 mol/(L·min),下列结论错误的是 ( ) 2NH3(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,改变的这一条件是
2NH3(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,改变的这一条件是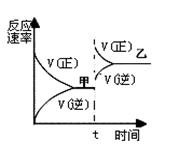
 2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
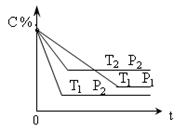
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是 xC(g) DH=" Q" kJ/mol ,在密闭容器中进行下图表示反应在不同时间t ,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则
xC(g) DH=" Q" kJ/mol ,在密闭容器中进行下图表示反应在不同时间t ,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则