题目内容
【题目】某学习小组查阅资料可知高温下,FeCl2与O2反应一定生成Fe2O3,可能生成FeC13或Cl2。该小组同学利用如下装置对该反应进行探究。回答下列问题:
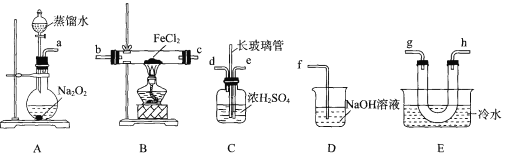
查阅资料:FeCl2固体呈绿色,熔点为674℃,沸点为1023℃;FeC13在100℃左右升华。
(l)装置A中盛放蒸馏水的仪器名称为____。
(2)按气流从左到右的顺序,上述装置合理的连接顺序为____(填仪器接口的小写字母)。
(3)装置C中浓硫酸的作用为 ___,长玻璃管的作用为 ___ 。
(4)实验结束后,用D中所得溶液设计实验证明此反应无Cl2生成 ___。
(5)实验过程中,B处硬质玻璃管中的现象为 ___;装置E中冷水的作用为 ____。
(6)由上述实验可知:高温下,FeCl2与O2反应的化学方程式为_____。
【答案】分液漏斗 aedbc(或cb)gh(或hg)f 除去氧气中的水蒸气 平衡压强,防止堵塞 取D中所得溶液少量置于洁净试管中,加入足量的稀硝酸将溶液酸化,再滴加少量的AgNO3溶液,无白色沉淀产生 固体由绿色变为红棕色,有棕色烟产生 降温,使FeCl3完全凝华 12FeCl2 + 3O2 ![]() 2Fe2O3 + 8FeCl3
2Fe2O3 + 8FeCl3
【解析】
(1)依据仪器构成作答;
(2)本实验是先制备并得到干燥的氧气后在装置B的硬质玻璃管中发生FeCl2与O2的反应,后续实验为了验证是否有FeC13或Cl2,依据实验探究的目的连接实验仪器;
(3)浓硫酸具有吸水性;长玻璃管可平衡内外气压;
(4)若有氯气生成,则D装置中会发生反应生成氯化钠与次氯酸钠,采用检验氯离子的方法作答即可;
(5)FeCl2固体呈绿色,Fe2O3成红棕色,FeC13为棕色,根据反应前后物质颜色变化分析现象;再依据已知给定条件结合FeC13的物理特性回答;
(6)根据实验探究可知,FeCl2与O2在高温下反应生成Fe2O3和FeC13,依据氧化还原反应的规律配平该化学方程式。
(1)该仪器名称为分液漏斗,
故答案为:分液漏斗;
(2)装置A中过氧化钠与蒸馏水反应生成氧气,后经过浓硫酸干燥氧气,再通入装置B的硬质玻璃管中在高温下FeCl2与干燥的O2反应,再连接U型管为了探究是否有FeC13并使FeC13凝华,装置D则是验证探究是否有氯气并可作吸收装置,因此其连接顺序为:aedbc(或cb)gh(或hg)f,
故答案为:aedbc(或cb)gh(或hg)f;
(3)装置A中制备的氧气中含有少量水蒸气,则装置C中浓硫酸的作用是除去氧气中的水蒸气,干燥氧气,其中长玻璃管的作用为:平衡压强,防止堵塞
故答案为:除去氧气中的水蒸气;平衡压强,防止堵塞;
(4)假设反应中有氯气生成,则装置D中会发生反应:Cl2 + NaOH = NaCl + NaClO + H2O,则检验装置D若无氯离子,则原装置B中无氯气生成,具体方法为:取D中所得溶液少量置于洁净试管中,加入足量的稀硝酸将溶液酸化,再滴加少量的AgNO3溶液,若无白色沉淀产生,则证明此反应无Cl2生成,
故答案为:取D中所得溶液少量置于洁净试管中,加入足量的稀硝酸将溶液酸化,再滴加少量的AgNO3溶液,无白色沉淀产生;
(5)实验探究得出FeCl2与O2反应生成Fe2O3和FeC13,则硬质玻璃管的现象为:固体由绿色变为红棕色,有棕色烟产生;根据已知条件可知,FeC13在100℃左右升华,则生成的FeC13需用冷水降温,使FeCl3完全凝华,便于收集FeC13,
故答案为:固体由绿色变为红棕色,有棕色烟产生;降温,使FeCl3完全凝华;
(6)FeCl2与O2在高温下反应生成Fe2O3和FeC13,其化学方程式为:12FeCl2 + 3O2 ![]() 2Fe2O3 + 8FeCl3,
2Fe2O3 + 8FeCl3,
故答案为:12FeCl2 + 3O2 ![]() 2Fe2O3 + 8FeCl3。
2Fe2O3 + 8FeCl3。

【题目】H2是一种重要的清洁能源。
(1)2018年我国某科研团队利用透氧膜,一步即获得合成氨原料和合成液态燃料的原料。其工作原理如图所示(空气中N2与O2的物质的量之比按4:1计)。工作过程中,膜I侧所得![]() =3,则膜I侧的电极方程式为________________________。
=3,则膜I侧的电极方程式为________________________。

(2)已知: CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2=-49.0kJ/mol,
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3= -41.1 kJ/mol,H2还原CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g)ΔH1,则ΔH1=_____________ kJ/mol,该反应自发进行的条件为_________。
CH3OH(g)ΔH1,则ΔH1=_____________ kJ/mol,该反应自发进行的条件为_________。
A.高温 B.低温 C.任何温度条件下
(3)恒温恒压下,在容积可变的密闭容器中加入1mol CO和2.2 mol H2,发生反应 CO(g)+2H2(g)![]() CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。
CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。

P1_______P2,判断的理由是____________________________。
(4)若反应CO(g)+2H2(g)![]() CH3OH(g)在温度不变且体积恒定为1L的密闭容器中发生,反应过程中各物质的物质的量随时间变化见下表所示:
CH3OH(g)在温度不变且体积恒定为1L的密闭容器中发生,反应过程中各物质的物质的量随时间变化见下表所示:
时间/min | 0 | 5 | 10 | 15 |
H2 | 4 | 2 | ||
CO | 2 | 1 | ||
CH3OH(g) | 0 | 0.7 |
①下列各项能作为判断该反应达到平衡标志的是_____(填字母);
A.容器内压强保持不变 B.2v正(H2)=v逆(CH3OH)
C.混合气体的相对分子质量保持不变 D.混合气体的密度保持不变
②若起始压强为P0 kPa,则在该温度下反应的平衡常数Kp=__________(kPa)-2。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③反应速率若用单位时间内分压的变化表示,则10min内H2的反应速率v(H2)= _______Pa/min。