题目内容
【题目】下列实验操作及现象和结论均正确的是

A. AB. BC. CD. D
【答案】B
【解析】
A.若有铵根离子存在,则生成的氨气能使湿润的红色石蕊试纸变蓝,不能使蓝色的石蕊试纸变红,故A错误;
B.KI3溶液中加入硝酸银溶液后产生了黄色沉淀,证明溶液中有I-存在;若加入淀粉溶液后,溶液变蓝,证明溶液中有I2存在。综上所述,可以证明KI3溶液中存在化学平衡:I3-I2+I-。故B正确;
C.裂化汽油中含有烯烃,能与溴水发生加成反应而使溴水褪色,故不能用其萃取溴水中的溴,C错误;
D.将SO2和CO2气体分别通入水中至饱和,由于前者在水中的溶解度较大、后者较小,故生成亚硫酸和碳酸的浓度不同,不能通过测定浓度不同的两种酸的pH值来比较其酸性,故D错误。
故选B。

 阅读快车系列答案
阅读快车系列答案【题目】H2是一种重要的清洁能源。
(1)2018年我国某科研团队利用透氧膜,一步即获得合成氨原料和合成液态燃料的原料。其工作原理如图所示(空气中N2与O2的物质的量之比按4:1计)。工作过程中,膜I侧所得![]() =3,则膜I侧的电极方程式为________________________。
=3,则膜I侧的电极方程式为________________________。

(2)已知: CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2=-49.0kJ/mol,
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3= -41.1 kJ/mol,H2还原CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g)ΔH1,则ΔH1=_____________ kJ/mol,该反应自发进行的条件为_________。
CH3OH(g)ΔH1,则ΔH1=_____________ kJ/mol,该反应自发进行的条件为_________。
A.高温 B.低温 C.任何温度条件下
(3)恒温恒压下,在容积可变的密闭容器中加入1mol CO和2.2 mol H2,发生反应 CO(g)+2H2(g)![]() CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。
CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。

P1_______P2,判断的理由是____________________________。
(4)若反应CO(g)+2H2(g)![]() CH3OH(g)在温度不变且体积恒定为1L的密闭容器中发生,反应过程中各物质的物质的量随时间变化见下表所示:
CH3OH(g)在温度不变且体积恒定为1L的密闭容器中发生,反应过程中各物质的物质的量随时间变化见下表所示:
时间/min | 0 | 5 | 10 | 15 |
H2 | 4 | 2 | ||
CO | 2 | 1 | ||
CH3OH(g) | 0 | 0.7 |
①下列各项能作为判断该反应达到平衡标志的是_____(填字母);
A.容器内压强保持不变 B.2v正(H2)=v逆(CH3OH)
C.混合气体的相对分子质量保持不变 D.混合气体的密度保持不变
②若起始压强为P0 kPa,则在该温度下反应的平衡常数Kp=__________(kPa)-2。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③反应速率若用单位时间内分压的变化表示,则10min内H2的反应速率v(H2)= _______Pa/min。
【题目】【有机化学基础】肉桂醛F (![]() )在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的:
)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的:

已知:两个醛分子在NaOH溶液作用下可以发生反应,生成一种羟基醛:
![]() +
+![]()
![]()
![]()
请回答:
(1)D的结构简式为 ;检验其中官能团的试剂为 。
(2)反应①~⑥中属于加成反应的是 (填序号)。
(3)写出有关反应③的化学方程式: 。
(4)在实验室里鉴定(![]() )分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是 (请按实验步骤操作的先后次序填写序号)。
)分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是 (请按实验步骤操作的先后次序填写序号)。
A.滴加AgNO3溶液 | B.加NaOH溶液 | C.加热 | D.用稀硝酸酸化 |
(5)下列关于E的说法正确的是 (填字母)。
a.能与银氨溶液反应 b.能与金属钠反应
c.1 mol E最多能和3 mol氢气反应 d.可以发生水解
(6)E的同分异构体有多种,其中之一甲符合条件:①苯环上只有一个取代基,②属于酯类,可由H和芳香酸G制得,现测得H分子的红外光谱和核磁共振氢谱如下图:(已知H的相对分子量为32)则甲的结构简式为
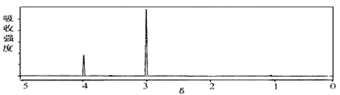
未知物H的核磁共振氢谱

未知物H的红外光谱




