��Ŀ����
����Ŀ���ڱ�״���£���22.4LHCl��ȫ����1Lˮ��(ˮ���ܶȽ���Ϊ1g/mL)����Һ���ܶ�Ϊ��g/cm3(��>1)����Һ�����ΪVmL�����ʵ���������Ϊw�����ʵ����ʵ���Ũ��Ϊc mol/L��������������ȷ����
��w=![]() ��100% ��c=1molL��1 ����������Һ���ټ���VmLˮ��������Һ��������������0.5w����������Һ���ټ���VmLˮ��������Һ����������С��0.5w
��100% ��c=1molL��1 ����������Һ���ټ���VmLˮ��������Һ��������������0.5w����������Һ���ټ���VmLˮ��������Һ����������С��0.5w
A.�٢�B.�ڢ�C.�٢�D.�٢�
���𰸡�C
��������
�ٸ������ʵ���Ũ��c=![]() ���ɵ�w=
���ɵ�w=![]() ��100%������ȷ��
��100%������ȷ��
��36.5g HCl�����ʵ���Ϊ1mol��1molHCl�ܽ���1Lˮ�У�������Һ�������1L��Ũ�Ȳ���1mol/L���ڴ���
��������ܶȴ���ˮ���ܶȣ������������ˮ������ˮ������С��ԭ���������������w= ��100%��֪�����Һ��������С��ԭ�ȵ�2��������Һ�����ʵ�������������ԭ��Һ��1�룬������0.5w������ȷ��
��100%��֪�����Һ��������С��ԭ�ȵ�2��������Һ�����ʵ�������������ԭ��Һ��1�룬������0.5w������ȷ��
��������ܶȴ���ˮ���ܶȣ������������ˮ������ˮ������С��ԭ���������������w= ��100%��֪�����Һ��������С��ԭ�ȵ�2��������Һ�����ʵ�������������ԭ��Һ��1�룬������0.5w���ܴ���������ȷ��Ϊ�٢ۣ�
��100%��֪�����Һ��������С��ԭ�ȵ�2��������Һ�����ʵ�������������ԭ��Һ��1�룬������0.5w���ܴ���������ȷ��Ϊ�٢ۣ�
�ʺ���ѡ����C��

����Ŀ��ijʵ��С���KSCN�����ʽ���̽�����������ʵ�飺
�Թ����Լ� | ʵ�� | �μ��Լ� | ���� |
| �� | ��.�ȼ�1mL 0.1 mol/L FeSO4��Һ ��.�ټ������ữ��KMnO4��Һ | ��.���������� ��.�ȱ�죬����ɫ |
�� | ��.�ȼ�1mL 0.05 mol/L Fe2(SO4)3��Һ ��.�ٵμ�0.5 mL 0.5 mol/L FeSO4��Һ | ��.��Һ��� ��.��ɫ���Ա�dz |
��1��SCN���������ֽṹʽ���ֱ�ΪN��C��S����S=C=N����SCN���Ƕ��ߵĻ����칹�Ļ�����д��N��C��S���ĵ���ʽ__________��
��2�������ӷ���ʽ��ʾFeSO4��Һ�����Ե�ԭ��__________��
��3���������ӷ���ʽ��ʾʵ�����Һ����ԭ��____________________________��

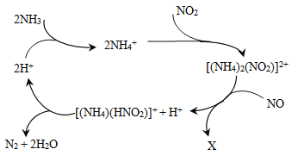
�����ʵ����к�ɫ��ȥ��ԭ��С��ͬѧ��Ϊ��SCN��������KMnO4����ΪSO42�������������ͼʵ��װ��֤ʵ�˲����dz����ġ�����X��Һ��_______��Y��Һ��_______���������SO42���IJ�����������_____________��
��4�����ʵ���ɫ���Ա�dz��������ʵ��С�����̽����
��ͬѧ�����ϵ�֪��������ǿ����ʺ����������Ӽ�����ã�����֮��ǣ��������ǿ��������ЧӦ��������ЧӦ��ʹFe3++SCN��![]() [Fe(SCN)]2+ƽ����ϵ�е�Fe3+��SCN����ϳ�[Fe(SCN)]2+�Ļ�����٣���Һ��ɫ��dz��
[Fe(SCN)]2+ƽ����ϵ�е�Fe3+��SCN����ϳ�[Fe(SCN)]2+�Ļ�����٣���Һ��ɫ��dz��
��ͬѧ��ΪSCN��������Fe2+��Ӧ������ɫ������ӣ���һ��ʹFe3++SCN��![]() [Fe(SCN)]2+ƽ�����ƣ���ɫ���Ա�dz����Mg2+��SCN������ϣ����������������ʵ�飺
[Fe(SCN)]2+ƽ�����ƣ���ɫ���Ա�dz����Mg2+��SCN������ϣ����������������ʵ�飺

�ɴ��Ʋ⣬ʵ���ɫ���Ա�dz����ԭ����___________________��
��5����ҵ�ϲⶨ�����Ͻ����Ѻ���������һ����Ӧԭ���ǣ���KSCNΪָʾ������NH4Fe(SO4)2����Һ�ζ�Ti������Ӧ�Ļ�ѧ����ʽΪ��Ti2(SO4)3+2NH4Fe(SO4)2===2Ti(SO4)2+(NH4)2SO4+2FeSO4����ﵽ�ζ��յ��ʵ��������______��
����Ŀ����ˮMgBr2������������ʵ���Ҳ���þм��Һ��Ϊԭ���Ʊ���ˮMgBr2��װ����ͼ1����Ҫ�������£�


����1 ����ƿ��װ��10 gþм��150 mL��ˮ���ѣ�װ��B�м���15 mLҺ�塣
����2 ����ͨ�����ĵ�����ֱ������ȫ��������ƿ�С�
����3 ��Ӧ��Ϻ�ָ������£����ˣ���Һת������һ�������ƿ�У���ȴ��0�����������壬�ٹ��˵������Ѻ��廯þ��Ʒ��
����4 �������ñ��ܽ��Ʒ����ȴ��0�����������壬���ˣ�ϴ�ӵ������Ѻ��廯þ��������160���ֽ����ˮMgBr2��Ʒ��
��֪����Mg��Br2��Ӧ���ҷ��ȣ�MgBr2����ǿ��ˮ�ԡ�
��MgBr2+3C2H5OC2H5![]() MgBr2��3C2H5OC2H5
MgBr2��3C2H5OC2H5
��ش�
��1������A��������____________��
ʵ���в����ø�������������N2��ԭ����___________��
��2���罫װ��B��Ϊװ��C��ͼ2�������ܻᵼ�µĺ����___________��
��3������3�У���һ�ι��˳�ȥ��������___________��
��4���йز���4��˵������ȷ����___________��
A������95%���Ҵ����汽�ܽ��Ʒ | B��ϴ�Ӿ����ѡ��0���ı� |
C��������160������ҪĿ���dz�ȥ�� | D���ò����Ŀ���dz�ȥ���ѺͿ��ܲ������� |
��5��Ϊ�ⶨ��Ʒ�Ĵ��ȣ�����EDTA����дΪY4-������Һ�ζ�����Ӧ�����ӷ���ʽ��
Mg2++ Y4-="===Mg" Y2-
���ζ�ǰ��ϴ�ζ��ܵIJ���������__________��
���ⶨʱ���ȳ�ȡ0.2500g��ˮMgBr2��Ʒ���ܽ����0.0500 mol��L-1��EDTA����Һ�ζ����յ㣬����EDTA����Һ26.50 mL��������ˮMgBr2��Ʒ�Ĵ�����________________________��������������ʾ����