题目内容
某一元弱酸(用HA表示)在水中的电离方程式是:HA H++A-,回答下列问题:
H++A-,回答下列问题:
(1)向溶液中加入适量NaA固体, 以上平衡将向______(填“正”、“逆”)向移动,理由是______________________。
(2)若向溶液中加入适量NaCl溶液,以上平衡将向____(填“正”、“逆”)向移动,溶液中c(HA)将________(填“增大”、“减小”或“不变”),溶液中c(OH-)将______(填“增大”、“减小”或“不变”)。
(3)试设计实验方案证明HA为弱酸_______________________________________。
 H++A-,回答下列问题:
H++A-,回答下列问题:(1)向溶液中加入适量NaA固体, 以上平衡将向______(填“正”、“逆”)向移动,理由是______________________。
(2)若向溶液中加入适量NaCl溶液,以上平衡将向____(填“正”、“逆”)向移动,溶液中c(HA)将________(填“增大”、“减小”或“不变”),溶液中c(OH-)将______(填“增大”、“减小”或“不变”)。
(3)试设计实验方案证明HA为弱酸_______________________________________。
(8分) (1)逆(1分) c(A-)增大,平衡向减小c(A-)的方向移动即逆向移动(2分) (2)正(1分) 减小(1分) 增大(1分) (3) 测0.1 mol·L-1 HA溶液的PH,若溶液的PH>1则它为弱酸(2分)
试题分析:(1) 加入NaA固体,A-增多,故平衡将向逆向移动,理由为c(A-)增大,平衡向减小c(A-)的方向移动即逆向移动。
(2)加入NaCl溶液,不反应,相当于加入水,溶液浓度变小,平衡将向正向移动,溶液中c(HA)将减小,c(H+)减小,则溶液中c(OH-)将增大。
(3) 证明HA为弱酸方法很多,比如:测0.1 mol·L-1 HA溶液的PH,若溶液的PH>1则它为弱酸。
点评:本题综合考查弱电解质的电离问题,题目较难,做题时注意把握“较强酸+较弱酸盐→较强酸盐+较弱酸”的反应规律。

练习册系列答案
相关题目
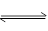 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下: A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。 2E(g)若开始时只充入2molE(g),达平衡时,混合气体的压强比起始时增大了20%; 若开始时只充入2molM和1molN的混合气体,达平衡时M的转化率为( )
2E(g)若开始时只充入2molE(g),达平衡时,混合气体的压强比起始时增大了20%; 若开始时只充入2molM和1molN的混合气体,达平衡时M的转化率为( )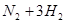
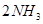 达到平衡的标志是
达到平衡的标志是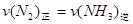
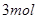
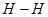 键断裂,同时
键断裂,同时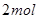
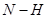 键断裂
键断裂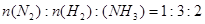
 pC(g);△H<0。在一定温度下,平衡时B的体积分数(B%)与压强的关系如图所示,下列叙述中一定正确的是:
pC(g);△H<0。在一定温度下,平衡时B的体积分数(B%)与压强的关系如图所示,下列叙述中一定正确的是: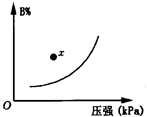
 2SO3,若用2 mol SO2和1 mol 18O2在一定条件下,经足够长的时间反应,下列情况可能出现的是
2SO3,若用2 mol SO2和1 mol 18O2在一定条件下,经足够长的时间反应,下列情况可能出现的是 2(t-BuNO) 。
2(t-BuNO) 。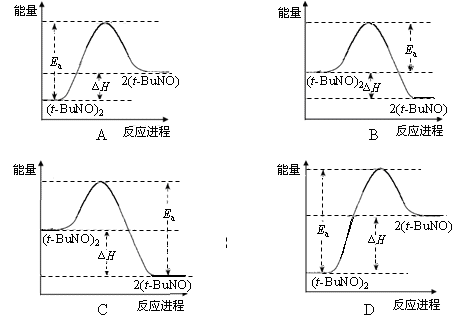
 2NO+O2的反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
2NO+O2的反应。反应过程中NO2的物质的量随时间变化的状况如图所示。