题目内容
在容积为V L的密闭容器中发生2NO2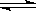 2NO+O2的反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
2NO+O2的反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
(1)若曲线A和B表示的是该反应在某不同条件下的反应状况,则该不同条件是
A.有、无催化剂 B.压强不同 C.温度不同
(2)写出该反应的化学平衡常数K的表达式 ,并比较K800℃ K850℃(填>、<或=)。
(3)求在B条件下从反应开始至达到平衡,氧气的反应速率VO2= 。
(4)能说明该反应已达到平衡状态的是
A.V正(NO2)=V逆(NO)
B.C(NO2)=C(NO)
C.气体的平均摩尔质量不变
D.气体的密度保持不变
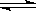 2NO+O2的反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
2NO+O2的反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
(1)若曲线A和B表示的是该反应在某不同条件下的反应状况,则该不同条件是
A.有、无催化剂 B.压强不同 C.温度不同
(2)写出该反应的化学平衡常数K的表达式 ,并比较K800℃ K850℃(填>、<或=)。
(3)求在B条件下从反应开始至达到平衡,氧气的反应速率VO2= 。
(4)能说明该反应已达到平衡状态的是
A.V正(NO2)=V逆(NO)
B.C(NO2)=C(NO)
C.气体的平均摩尔质量不变
D.气体的密度保持不变
(1)C(2)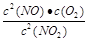 <(3)
<(3)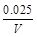 mol/(L·s)(4)AC
mol/(L·s)(4)AC
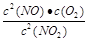 <(3)
<(3)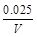 mol/(L·s)(4)AC
mol/(L·s)(4)AC试题分析:(1)B比A反应速率快但平衡时B比A中NO2物质的量小,催化剂对平衡移动无影响,所以不可能是使用催化剂。增大压强,平衡向左移动,NO2物质的量增大,B错误;升高温度,平衡向右移动,NO2物质的量减小,C正确。(2)该反应正反应是吸热反应,温度越高,K越大。(3)B条件下v(NO2)=
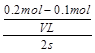 =
=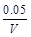 mol/(L·s),所以v(O2)=
mol/(L·s),所以v(O2)=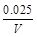 mol/(L·s)。(4)NO2与NO化学计量数相等,所以V正(NO2)=V逆(NO)是平衡状态,A正确;NO和NO2浓度相等不是平衡状态的标志,二者浓度不变是平衡状态的标志,B错误;气体的平均摩尔质量=
mol/(L·s)。(4)NO2与NO化学计量数相等,所以V正(NO2)=V逆(NO)是平衡状态,A正确;NO和NO2浓度相等不是平衡状态的标志,二者浓度不变是平衡状态的标志,B错误;气体的平均摩尔质量=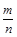 ,反应物和生成物都是气体,所以气体总质量守恒;反应后气体物质的量增大,气体平均摩尔质量减小,所以气体摩尔质量不变时是平衡状态,C正确;气体的密度=
,反应物和生成物都是气体,所以气体总质量守恒;反应后气体物质的量增大,气体平均摩尔质量减小,所以气体摩尔质量不变时是平衡状态,C正确;气体的密度= ,反应物和生成物都是气体,所以气体总质量守恒,容器容积固定,气体的体积不变,所以无论是平衡状态还是非平衡状态,气体的密度均不变,D错误。
,反应物和生成物都是气体,所以气体总质量守恒,容器容积固定,气体的体积不变,所以无论是平衡状态还是非平衡状态,气体的密度均不变,D错误。点评:图中曲线B达到平衡需要的时间比曲线A少,说明B条件下反应速率快,可能是浓度大、温度高、压强大、使用催化剂;再研究A、B条件下平衡时NO2物质的量可知B条件下NO2物质的量小,根据勒沙特列原理作出判断。

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
 H++A-,回答下列问题:
H++A-,回答下列问题: Z(g)+2W(g),△H<0。达到平衡时V(A)=1.2aL。试回答:
Z(g)+2W(g),△H<0。达到平衡时V(A)=1.2aL。试回答:
 CO2+H2在1000 K达到平衡时,分别改变下列条件,平衡常数K值发生变化的是( )
CO2+H2在1000 K达到平衡时,分别改变下列条件,平衡常数K值发生变化的是( ) 2HI(g)
2HI(g)  H<0, 达到平衡后,当改变外界条件如物质浓度、体系压强等而发生下列项目的变化时,能做为平衡一定发生了移动的标志的是( )
H<0, 达到平衡后,当改变外界条件如物质浓度、体系压强等而发生下列项目的变化时,能做为平衡一定发生了移动的标志的是( )  CO2(g)+H2(g), 若反应达平衡时测得CO转化率为40%,则该条件下该反应的平衡常数为
CO2(g)+H2(g), 若反应达平衡时测得CO转化率为40%,则该条件下该反应的平衡常数为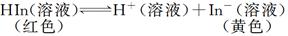
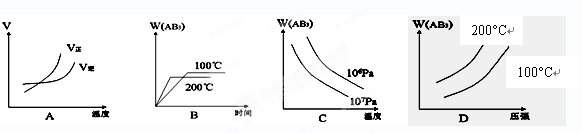
 2AB3(g) △H<0,下列图像正确的是( )
2AB3(g) △H<0,下列图像正确的是( )