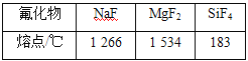
题目内容
【题目】下列的图示与对应的叙述相符的是( )
A.如图表示向A1Cl3溶液中滴加NaOH溶液时n [Al(OH)3]的变化情况
B.如图表示KNO3的溶解度曲线,图中a点表示的溶液通过升温可以得到b点
C.如图表示某一放热反应,若使用催化剂,E1、E2、△H都会发生改变
D.如图表示向Na2CO3溶液中滴加稀盐酸时,产生n (CO2)的情况
【答案】A
【解析】
A. 氯化铝和氢氧化钠反应生成氢氧化铝和氯化钠的反应,反应的化学方程式为:AlCl3+3NaOH=Al(OH)3↓+3NaCl;氢氧化铝沉淀溶解的过程,反应生成偏铝酸钠和水,反应的离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,前后NaOH的物质的量之比为3:1,符合此图,故A正确;
B. b点为硝酸钾在80℃时的饱和溶液,a点为不饱和溶液,可以通过升高温度蒸发掉部分溶剂,然后恢复到80℃可以变成饱和溶液,但是仅仅升高温度不行,故B错误;
C. 催化剂能改变活化能,但不能改变反应热,故C错误;
D. 向Na2CO3溶液中逐滴加入盐酸时,发生的反应依次为Na2CO3+HCl=NaCl+NaHCO3和NaHCO3+HCl=NaCl+CO2↑+H2O,不会立刻产生二氧化碳,故D错误;
正确答案是A。

【题目】活性炭可处理大气污染物NO。为模拟该过程,T℃时,在3L密闭容器中加入NO和活性炭粉,反应体系中各物质的量变化如下表所示。下列说法正确的是
活性炭/mol | NO/mol | X/mol | Y/mol | |
起始时 | 2.030 | 0.100 | 0 | 0 |
10min达平衡 | 2.000 | 0.040 | 0.030 | 0.030 |
A. X一定是N2,Y一定是CO2
B. 10min后增大压强,NO的吸收率增大
C. 10min后加入活性炭,平衡向正反应方向移动
D. 0~10min的平均反应速率v(NO)=0.002 mol/(Lmin)