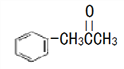
题目内容
【题目】容量瓶是用来配制物质的量浓度的溶液的定量仪器,其上标有:①温度 ②浓度 ③容量 ④压强⑤刻度线 ⑥酸式或碱式这六项中的( )
A.②④⑥
B.③⑤⑥
C.①②④
D.①③⑤
【答案】D
【解析】解:容量瓶是用来配制一定体积、一定物质的量浓度溶液的定量容器,容量瓶上标有容量,则③⑤正确;容量瓶只能在常温下使用,不能用来盛装过冷或过热的液体,不能用来稀释溶液或作为反应容器,则①正确,与浓度、压强、酸式或碱式无关,所以正确的是①③⑤, 故选D.
根据容量瓶的使用方法分析,容量瓶是用来配制一定物质的量浓度溶液的定量容器,只能在常温下使用,不能用来盛装过冷或过热的液体,不能用来稀释溶液或作为反应容器.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目