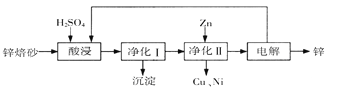
题目内容
【题目】已知下列热化学方程式:
①H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
②H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
③C(s)+![]() O2(g)=CO(g) ΔH=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH=-110.5 kJ·mol-1
④C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1,
回答下列问题:
(1)H2的燃烧热为____________;C的燃烧热为____________。
(2)燃烧10 g H2生成液态水,放出的热量为____________。
(3)写出CO燃烧的热化学方程式__________________________________。
【答案】 285.8 kJ·mol-1 393.5 kJ·mol-1 1429kJ CO(g)+ ![]() O2(g)=CO2(g) ΔH=-283.5 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.5 kJ·mol-1
【解析】(1)燃烧热是指在25℃,101 kPa时,1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式中可燃物的物质的量为1mol,产物必须是稳定氧化物。根据燃烧热的定义,1mol H2燃烧生成液态水更稳定,所以①H2(g)+![]() O2 (g)=H2O(l);△H=﹣285.8 kJ·mol-1为H2燃烧热的化学方程式,所以H2的燃烧热为:285kJmol﹣1;1mol碳完全燃烧生成CO2时放出的热量为碳的燃烧热,④C(s)+O2(g)=CO2(g);△H=﹣393.5kJ/mol﹣1为碳燃烧热的化学方程式,所以碳的燃烧热为:393.5 kJ·mol-1;故答案为:285.8 kJ·mol-1;393.5 kJ·mol-1;
O2 (g)=H2O(l);△H=﹣285.8 kJ·mol-1为H2燃烧热的化学方程式,所以H2的燃烧热为:285kJmol﹣1;1mol碳完全燃烧生成CO2时放出的热量为碳的燃烧热,④C(s)+O2(g)=CO2(g);△H=﹣393.5kJ/mol﹣1为碳燃烧热的化学方程式,所以碳的燃烧热为:393.5 kJ·mol-1;故答案为:285.8 kJ·mol-1;393.5 kJ·mol-1;
(2)根据方程式①可知每燃烧1molH2生成H2O(l),放出热量285.8kJ,1molH2质量为2g,所以燃烧10g H2生成液态水,放出的热量为285.8kJ ×5=1429kJ。
(3)CO燃烧的化学方程式为CO(g)+ ![]() O2(g)=CO2(g),根据盖斯定律,将④﹣③即可得:CO(g)+
O2(g)=CO2(g),根据盖斯定律,将④﹣③即可得:CO(g)+ ![]() O2(g)=CO2(g) △H=-393.5kJ/mol-(-110.5 kJ/mol)= -283.5 kJ·mol-1。故答案为:CO(g)+
O2(g)=CO2(g) △H=-393.5kJ/mol-(-110.5 kJ/mol)= -283.5 kJ·mol-1。故答案为:CO(g)+ ![]() O2(g)=CO2(g) ΔH=-283.5 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.5 kJ·mol-1