题目内容
【题目】平板电视显示屏生产过程中产生大量的废玻璃(含SiO2、Fe2O3、CeO2、FeO等物质)。某小组以此废玻璃为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4。
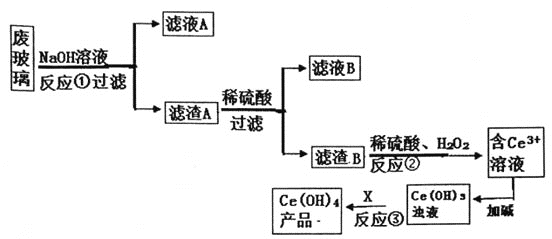
己知:CeO2不溶于强酸或强碱;Ce3+易水解,酸性条件下,Ce4+有强氧化性。
(1)反应①的离子方程式________________________。
(2)反应②的离子方程武是_____________________________。
(3)为了得到较纯的Ce3+溶液,反应②之前要进行的操作是______
(4)反应③需要加入的试剂X可以是______________。
(5)用滴定法测定制得的Ce(OH)4产品纯度。
![]()
用FeSO4溶液滴定用_____做指示剂,滴定终点的现象_________。
【答案】SiO2+2OH-=SiO32-+H2O 2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O 洗涤 O2或其它合理答案 K3[Fe(CN)6] 最后一滴溶液时,生成淡蓝色沉淀,且振荡也不再消失
【解析】
抓住已知信息,CeO2不溶于强酸或强碱;推出滤渣A、滤液A的成分;一般金属氧化物溶于酸,分析出滤渣B,滤液B的成分;再根据氧化还原反应进行推导。
(1)废玻璃在NaOH溶液中,CeO2不溶于强酸或强碱,一般金属氧化物溶于酸,只有SiO2参与反应,故反应①的离子方程式为SiO2+2OH=SiO32+H2O,
故答案为:SiO2+2OH=SiO32+H2O;
(2)滤渣B的主要成分是CeO2,且要生成Ce3+,发生了氧化还原反应,反应②的离子方程式是2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O,
故答案为:2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O;
(3)为了得到较纯的Ce3+溶液,反应②之前要进行的操作是洗涤,防止混有铁离子,
故答案为:洗涤;
(4)反应③由Ce(OH)3生成Ce(OH)4,则要加入氧化剂,故可知试剂X为O2或其他不引入杂质的氧化剂均可;
故答案为:O2;
(5)检验亚铁离子,可用高铁酸根离子,故滴定FeSO4溶液,用K3[Fe(CN)6]做指示剂,滴定终点的现象为滴入最后一滴溶液时,生成淡蓝色沉淀,且振荡30s不再消失;
故答案为:K3[Fe(CN)6];滴入最后一滴溶液时,生成淡蓝色沉淀,且振荡30s不再消失。