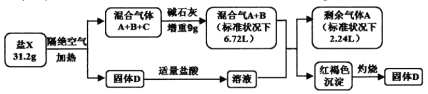
题目内容
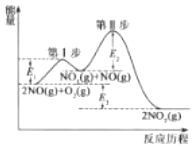
【题目】利用人工模拟光合作用合成甲酸的原理为2CO2+2H2O=2HCOOH+O2,装置如图所示,下列说法不正确的是( )
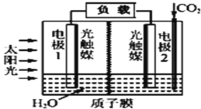
A.该装置能将太阳能转化为化学能和电能
B.电子由电极1经过负载流向电极2
C.电极2的反应式:CO2+2H++2e-=HCOOH
D.电极1周围pH增大
【答案】D
【解析】
根据电极反应式可知,CO2是氧化剂得电子发生还原反应,电极2为正极,电极反应式为CO2+2H++2e-=HCOOH,水是还原剂,失电子,电极1为负极,电极反应式为2H2O-4e-=4H++O2↑。
A.该过程中有光合作用存在,太阳能转化为化学能,且有电流产生,太阳能转化为电能,故A正确;
B.电子由负极流向正极,故B正确;
C.电极2为正极,电极反应式为CO2+2H++2e-=HCOOH,故C正确;
D.电极1为负极,发生氧化反应,电极反应式为2H2O-4e-=4H++O2↑,pH减小,故D错误;
故选D。

 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300 ℃以上完全分解 ②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险 ④受热或遇水分解放热,放出腐蚀性烟气 | ||||
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品,氯气过量则会生成SCl2。

①仪器m 的名称为__________,装置F 中试剂的作用是_________。
②装置连接顺序: A![]() ______
______![]()
![]()
![]() E
E![]() D。
D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是_____________。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和____________。
(2)少量S2Cl2泄漏时应喷水雾减慢其挥发(或扩散),并产生酸性悬浊液,但不要对泄漏物或泄漏点直接喷水,其原因是______________。
(3)S2Cl2遇水会生成SO2、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中SO2的体积分数。

①W溶液可以是_____(填标号)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中二氧化硫的体积分数为_________(用含V、m 的式子表示)。