题目内容
【题目】按要求填些对应的化学符号
(1)质量数为37的氯原子符号为________。
(2)S2-的结构示意图________。
(3) N2的电子式________
(4)磷原子的核外电子排布式__________铬原子价电子排布图_____________
(5)A元素基态原子的最外层有2个未成对电子,次外层有2个电子,其元素符号为__________。
(6)B元素的正三价离子的3d能级为半充满,其基态原子的电子排布式为___________
(7)O、N、F 3种元素的第一电离能由大到小的顺序为________(用元素符号表示)
(8)前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子数相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。四种元素中,D元素在周期表中的位置____第一电离能最小的是_____(填元素符号,下同),电负性最大的是______
(9)已知和碳元素同主族的X元素位于周期表中的第1个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们形成的化学式为XY4的物质。试回答:
X元素原子的基态电子排布式为__________
Y元素原子最外层电子的轨道表示式为________
若X、Y两元素电负性分别为2.1和2.85,则XY4中X与Y之间的化学键为_______(填“共价键”或“离子键”)。
【答案】![]() Cl
Cl ![]()
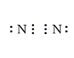 1s22s22p63s23p3
1s22s22p63s23p3 ![]() C或O 1s22s22p63s23p63d64s2或[Ar]3d64s2 F>N>O 第四周期第VIII族 K F 1s22s22p63s23p63d104s24p2
C或O 1s22s22p63s23p63d64s2或[Ar]3d64s2 F>N>O 第四周期第VIII族 K F 1s22s22p63s23p63d104s24p2 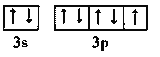 共价键
共价键
【解析】
(1)Cl的质子数为17,质量数为37,则质量数为37的氯原子符号为![]() Cl;
Cl;
(2)硫离子最外层得到两个电子达到8电子稳定结构,所以其结构示意图为:![]() ;
;
(3)氮气分子中氮原子之间以氮氮三键形成氮分子,其电子式为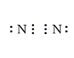 ;
;
(4)磷元素核外有15个电子,根据书写规则知有3层,s轨道最多容纳两个电子,p轨道最多容纳6个电子,所以磷原子的核外电子排布式为1s22s22p63s23p3或[Ne]3s23p3;
铬是24号元素,其原子核外有24个电子,3d能级上有5个电子、4s能级上有1个电子,3d、4s电子为其价电子,所以其价电子排布图为![]() ;
;
(5)A元素基态原子的最外层有2个未成对电子,次外层有2个电子,原子只能有2个电子层,核外电子排布式为1s22s22p2或1s22s22p4,为C或O;
(6)某元素的正三价离子的3d轨道为半充满,3d轨道电子数为5,该三价离子的电子排布式为1s22s22p63s23p63d5,则该元素基态原子的电子排布式为:1s22s22p63s23p63d64s2或[Ar]3d64s2;
(7)同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,F、N、O元素处于同一周期且原子序数逐渐增大,N处于第VA族,所以第一电离能F>N>O;
(8)前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有一个,并且A-和B+的电子数相差为8,A属于第VIIA族元素,B属于第IA族元素,且A的原子序数小于B,则A是F元素,B是K元素;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2,价电子排布式分别为3d64s2、3d84s2,则C是Fe元素,D是Ni元素。
D为Ni元素,在周期表中的位置第四周期第VIII族;
四种元素中K的金属性最强,F的非金属性最强,故第一电离最小的是K,电负性最大的是F;
(9)由题意知,X元素为Ge元素,Y元素为Cl元素,原子结构示意图为 。
。
Ge元素原子的基态电子排布式为:1s22s22p63s23p63d104s24p2;Cl元素原子最外层电子的轨道表达式为 ;
;
Ge、Cl两元素的电负性差值为0.75,数值较小,所以二者形成共价键。

【题目】硝基苯甲酸乙酯在OH-存在下发生水解反应:O2NC6H4COOC2H5+OH-O2NC6H4COOO-+C2H5OH两种反应物的初始浓度均为0.050mol/L,在不同温度下测得O2NC6H4COOC2H5的浓度(mol/L)随时间变化的数据如下表所示。下列有关说法不正确的是( )
t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
15℃ | 0.500 | 0.335 | 0.291 | 0.256 | 0.210 | 0.155 | 0.148 | 0.145 | 0.145 |
35℃ | 0.500 | 0.325 | 0.2775 | 0.238 | 0.190 | … | 0.135 | 0.135 | 0.135 |
A. 该反应在![]() ,120180s区间内O2NC6H4COOC2H5平均反应速率为7.33×10 -4 mol·L-1·s-1
,120180s区间内O2NC6H4COOC2H5平均反应速率为7.33×10 -4 mol·L-1·s-1
B. 由数据可知,随着反应的进行,反应物的浓度降低,反应速率减慢
C. 530s时,表格中35℃对应的数据一定是0.135
D. 由数据可知,温度升高反应速率加快