题目内容
【题目】氯气是一种重要的化工原料,在生活和生产中的应用十分广泛。
请回答:
(1)在工业上,“氯碱工业”是生产氯气的主要方法。请写出工业制备氯气的离子方程式__________________________。
(2)实验室常用MnO2 与浓盐酸反应制备Cl2,装置如图1所示:
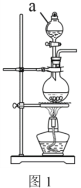
仪器a的名称为______。制备实验开始时,先检査装置气密性,接下来的操作依次是:___________(填序号)。
①往烧瓶中加入MnO2粉末 ②加热 ③往烧瓶中加入浓盐酸
(3)为证明Cl2与H2O反应为可逆反应,将生成的气体通入图2所示装置:

①装置A中应加入的试剂是____________。
②证明可逆反应,需验证在B中反应物和生成物同时存在,证明氯水中有Cl2存在的现象是______,仅使用一种试剂证明氯水中HCl和HClO均存在,合适的试剂是_____。
A.AgNO3溶液 B.石蕊试液
C.NaOH溶液 D.品红溶液
③装置C中NaOH溶液的作用是___________________。
(4)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度(残余液体积已知)。甲同学提出下列具体方案。请你从下列实验方案中选择合理的实验方法______。
A.在残余液中加入足量AgNO3溶液,过滤,洗涤,干燥,称量沉淀的质量
B.在残余液中加入足量NaHCO3固体,将反应后的气体直接用碱石灰吸收,测定生成的气体的质量
C.在残余液中加入足量锌片,测量生成气体的体积,折算成标准状况下的体积
【答案】2Cl-+2H2O![]() Cl2↑+H2↑+2OH- 分液漏斗 ①③② 饱和食盐水 装置B中的溶液呈黄绿色 B 尾气吸收 C
Cl2↑+H2↑+2OH- 分液漏斗 ①③② 饱和食盐水 装置B中的溶液呈黄绿色 B 尾气吸收 C
【解析】
(1)“氯碱工业”的主要原理为电解饱和食盐水可以得到氢氧化钠、氯气和氢气,反应方程式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,反应的离子方程式为2Cl-+2H2O
2NaOH+H2↑+Cl2↑,反应的离子方程式为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O
Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-;
Cl2↑+H2↑+2OH-;
(2)根据装置图,仪器a为分液漏斗,制备实验开始时,先检査装置气密性,然后加入药品,加药顺序一般是先加入固体药品,再加入液药品,最后再加热。所正确的顺序是:①③②,故答案为:分液漏斗;①③②;
(3)①要证明Cl2与H2O反应为可逆反应,需要排除氯化氢的干扰,装置A中应加入饱和食盐水,用来除去气体中的氯化氢,故答案为:饱和食盐水;
②证明可逆反应,需验证在B中反应物和生成物同时存在,证明氯水中有Cl2存在的现象是:装置B中的溶液呈黄绿色;仅使用一种试剂证明氯水中HCl和HClO均存在,利用盐酸的酸性和次氯酸的漂白性,合适的试剂是石蕊试液,先变红色后褪色证明氯化氢和次氯酸的存在,故答案为:装置B中的溶液呈黄绿色;B;
③氯气有毒,不能直接排放,因此装置C中NaOH溶液可以将尾气吸收,防止氯气污染空气,故答案为:尾气吸收;
(4)A.残余液中含有未反应的盐酸和生成的氯化锰,在残余液中加入足量AgNO3溶液,过滤,洗涤,干燥,称量沉淀的质量,包含生成盐中氯离子生成的沉淀,不能测定反应残余液中盐酸的浓度,故A错误;B.残余液中含有未反应的盐酸和生成的氯化锰,在残余液中加入足量NaHCO3固体,盐酸与碳酸氢钠反应放出二氧化碳(含有水蒸气),将反应后的气体直接用碱石灰吸收,测定生成的气体的质量为二氧化碳和水蒸气的质量,不能测定反应残余液中盐酸的浓度,故B错误;C.残余液中含有未反应的盐酸和生成的氯化锰,在残余液中加入足量锌片,只有盐酸与锌反应放出氢气,测量生成气体的体积,折算成标准状况下的体积,可以测定剩余盐酸的浓度,故C正确;故答案为:C。





