题目内容
【题目】将112mLCl2(标准状况)通入5mL1mol/L的FeBr2溶液中(还原性:Fe2+大于Br-),发生反应的离子方程式是( )
A.Cl2+2Br-=2Cl-+Br2B.2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2
C.2Fe2++Cl2=2Fe3++2Cl-D.2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2
【答案】B
【解析】
根据还原性Fe2+>Br-可知,通入氯气先发生反应:2Fe2++Cl2═2Fe3++2Cl-,Fe2+反应完毕,剩余的氯气再发生反应2Br-+Cl2═Br2+2Cl-。
标况下112mL氯气的物质的量为:n(Cl2)=![]() =0.005mol,5mL1mol/L的FeBr2溶液中含有溶质溴化亚铁的物质的量为:n(FeBr2)=1mol/L×0.005L=0.005mol,含有亚铁离子的物质的量为0.005mol,溴离子的物质的量为0.01mol;根据反应2Fe2++Cl2═2Fe3++2Cl-可知,0.005mol亚铁离子完全反应消耗0.0025mol氯气,剩余氯气0.0025mol,剩余的氯气再发生反应2Br-+Cl2═Br2+2Cl-;0.0025mol氯气氧化Br-的物质的量是0.005mol,则反应的离子方程式为2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2,故选B。
=0.005mol,5mL1mol/L的FeBr2溶液中含有溶质溴化亚铁的物质的量为:n(FeBr2)=1mol/L×0.005L=0.005mol,含有亚铁离子的物质的量为0.005mol,溴离子的物质的量为0.01mol;根据反应2Fe2++Cl2═2Fe3++2Cl-可知,0.005mol亚铁离子完全反应消耗0.0025mol氯气,剩余氯气0.0025mol,剩余的氯气再发生反应2Br-+Cl2═Br2+2Cl-;0.0025mol氯气氧化Br-的物质的量是0.005mol,则反应的离子方程式为2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2,故选B。

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案【题目】第Ⅷ族元素![]() 、
、![]() 、
、![]() 性质相似,称为铁系元素,主要用于制造合金。回答下列问题:
性质相似,称为铁系元素,主要用于制造合金。回答下列问题:
(1)基态![]() 原子核外能量最高的电子位于_______能级,同周期元素中,基态原子未成对电子数与
原子核外能量最高的电子位于_______能级,同周期元素中,基态原子未成对电子数与![]() 相同的元素名称为______________。
相同的元素名称为______________。
(2)![]() 与酚类物质的显色反应常用于其离子检验,已知
与酚类物质的显色反应常用于其离子检验,已知![]() 遇邻苯二酚(
遇邻苯二酚(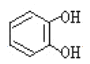 )和对苯二酚(
)和对苯二酚(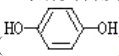 )均显绿色。邻苯二酚的熔沸点比对苯二酚_____(填“高”或“低”),原因是_________。
)均显绿色。邻苯二酚的熔沸点比对苯二酚_____(填“高”或“低”),原因是_________。
(3)有历史记载的第一个配合物是![]() (普鲁士蓝),该配合物的内界为__________。表为
(普鲁士蓝),该配合物的内界为__________。表为![]() 、
、![]() 不同配位数时对应的晶体场稳定化能(可衡量形成配合物时,总能量的降低)。由表可知,
不同配位数时对应的晶体场稳定化能(可衡量形成配合物时,总能量的降低)。由表可知,![]() 比较稳定的配离子配位数是__________(填“4”或“6”)。
比较稳定的配离子配位数是__________(填“4”或“6”)。![]() 性质活泼,易被还原,但
性质活泼,易被还原,但![]() 很稳定,可能的原因是________________。
很稳定,可能的原因是________________。
离子 | 配位数 | 晶体场稳定化能(Dq) |
| 6 | -8Dq+2p |
4 | -5.34Dq+2p | |
| 6 | -12Dq+3p |
4 | -3.56Dq+3p |
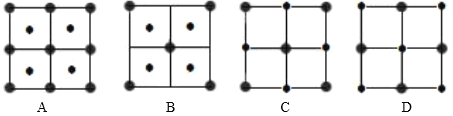
(4)![]() 晶体结构中阴阳离子的配位数均为6,则晶胞的俯视图可能是_______(填选项字母)。若晶胞参数为apm,阿伏加德罗常数的值为
晶体结构中阴阳离子的配位数均为6,则晶胞的俯视图可能是_______(填选项字母)。若晶胞参数为apm,阿伏加德罗常数的值为![]() ,晶体的密度是________
,晶体的密度是________![]() 。
。