题目内容
6.50克质量分数为7.3%的稀盐酸与足量大理石反应,生多少摩尔二氧化碳?分析 发生CaCO3+2HCl═CaCl2+H2O+CO2↑,结合n=$\frac{m}{M}$及反应方程式计算.
解答 解:n(HCl)=$\frac{50g×7.3%}{36.5g/mol}$=0.1mol,由生CaCO3+2HCl═CaCl2+H2O+CO2↑可知,n(CO2)=$\frac{1}{2}$n(HCl)=$\frac{1}{2}$×0.1mol=0.05mol,
答:生成0.05molCO2.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应及物质的量的关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
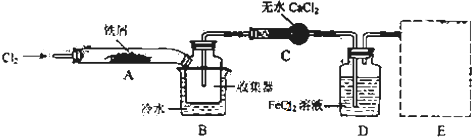
17. 某白色粉末有碳酸钠和亚硫酸钠中的一种或两种组成.某同学为探究其成分,设计实验方案如图所示(每种仪器所装试剂都足量)
某白色粉末有碳酸钠和亚硫酸钠中的一种或两种组成.某同学为探究其成分,设计实验方案如图所示(每种仪器所装试剂都足量)
(1)提出合理假设
假设一:该白色粉末成分为碳酸钠
假设二:该白色粉末成分为亚硫酸钠
假设三:该白色粉末成分为碳酸钠和亚硫酸钠的混合物
(2)将上述实验方案存在的主要错误和后果填在下表中(可不填满,也可补充)
(3)修正上述方案并完成探究实验,填写相应的实验现象
(4)下列试剂中能替代酸性高锰酸钾,澄清石灰水的是B
A.氢氧化钠溶液、氢氧化钡溶液 B.碘淀粉溶液,硅酸钠溶液
C.含酚酞的氨水、紫色石蕊试液 D.溴水、硝酸钡溶液
(5)实验过程中发现溶液不能顺利滴入烧瓶,请提出改进建议分液漏斗换成恒压分液漏斗.
 某白色粉末有碳酸钠和亚硫酸钠中的一种或两种组成.某同学为探究其成分,设计实验方案如图所示(每种仪器所装试剂都足量)
某白色粉末有碳酸钠和亚硫酸钠中的一种或两种组成.某同学为探究其成分,设计实验方案如图所示(每种仪器所装试剂都足量)(1)提出合理假设
假设一:该白色粉末成分为碳酸钠
假设二:该白色粉末成分为亚硫酸钠
假设三:该白色粉末成分为碳酸钠和亚硫酸钠的混合物
(2)将上述实验方案存在的主要错误和后果填在下表中(可不填满,也可补充)
| 错误 | 后果 |
| 假设编号 | 相应现象 |
| 假设一 | |
| 假设二 | |
| 假设三 |
A.氢氧化钠溶液、氢氧化钡溶液 B.碘淀粉溶液,硅酸钠溶液
C.含酚酞的氨水、紫色石蕊试液 D.溴水、硝酸钡溶液
(5)实验过程中发现溶液不能顺利滴入烧瓶,请提出改进建议分液漏斗换成恒压分液漏斗.
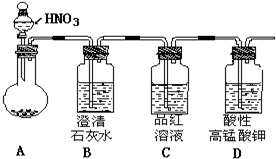
1.下列不能用勒沙特列原理解释的是( )
| A. | 工业合成氯化氢时使用过量氢气 | |
| B. | 实验室制备乙酸丁酯时使用过量乙酸 | |
| C. | 加热蒸干氯化铁的溶液,得到氢氧化铁固体 | |
| D. | 氯化银悬浊液中加入硫化钠溶液,产生黑色沉淀 |
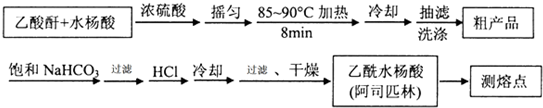
3.阿司匹林(乙酰水杨酸,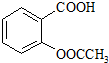 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
主要试剂和产品的物理常数
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是防止乙酸酐水解.
(2)写出制备阿司匹林的化学方程式 .
.
(3)①合成阿斯匹林时,最合适的加热方法是水浴加热.
②过滤所得粗产品要用少量冰水洗涤,则洗涤的具体操作是关闭水龙头,向漏斗中加冰水至浸没沉淀物,使洗涤剂缓慢通过沉淀物,重复上述操作2-3次.
(4)提纯粗产物中加入饱和NaHCO3溶液至没有CO2产生为止,再过滤,则加饱和NaHCO3溶液的目的是使乙酰水杨酸与NaHCO3溶液作用转化为易溶于水的乙酰水杨酸钠,与不溶性杂质分离.另一种改进的提纯方法,称为重结晶提纯法.方法如下:
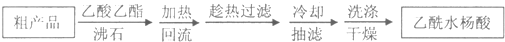
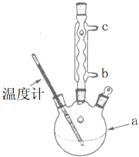
(5)改进的提纯方法中加热同流的装置如下图所示,使用温度计的目的是控制反应温度,防止温度过高,乙酰水杨酸受热分解.冷凝水的流进方向是b.(填“b”或“c”).
(6)检验产品中是否含有水杨酸的试剂是氯化铁溶液.
(7)该学习小组在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08g/cm3),最终称得产品m=2.2g,则所得乙酰水杨酸的产率为84.3%.
 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
主要试剂和产品的物理常数
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸 | 102 | 139.4(沸点) | 反应 |
| 乙酸水杨酸 | 180 | 135(熔点) | 微溶 |
(1)制备阿司匹林时,要使用干燥的仪器的原因是防止乙酸酐水解.
(2)写出制备阿司匹林的化学方程式
 .
.(3)①合成阿斯匹林时,最合适的加热方法是水浴加热.
②过滤所得粗产品要用少量冰水洗涤,则洗涤的具体操作是关闭水龙头,向漏斗中加冰水至浸没沉淀物,使洗涤剂缓慢通过沉淀物,重复上述操作2-3次.
(4)提纯粗产物中加入饱和NaHCO3溶液至没有CO2产生为止,再过滤,则加饱和NaHCO3溶液的目的是使乙酰水杨酸与NaHCO3溶液作用转化为易溶于水的乙酰水杨酸钠,与不溶性杂质分离.另一种改进的提纯方法,称为重结晶提纯法.方法如下:
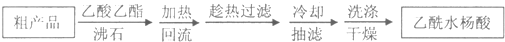
(5)改进的提纯方法中加热同流的装置如下图所示,使用温度计的目的是控制反应温度,防止温度过高,乙酰水杨酸受热分解.冷凝水的流进方向是b.(填“b”或“c”).

(6)检验产品中是否含有水杨酸的试剂是氯化铁溶液.
(7)该学习小组在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08g/cm3),最终称得产品m=2.2g,则所得乙酰水杨酸的产率为84.3%.
7.Al(OH)3溶度积Ksp为1.6×-33,则0.2mol•L-1AlCl3溶液不产生沉淀的最大OH-物质的量浓度(mol•L)为( )
| A. | 1.9×-33 | B. | 2.0×10-11 | C. | 8.0×10-33 | D. | 2.5×10-5 |
8.还原沉淀法是处理含铬(Cr2O72-和CrO42-)废水常用方法,过程如下:
CrO42-$\stackrel{H+}{→}$Cr2O72-$\stackrel{Fe_{2}+}{→}$Cr3+$\stackrel{OH-}{→}$Cr(OH)3
已知废水中Cr的含量为26.0g•L-1,当溶液中离子浓度小于10-5mol/L时认为离子已经沉淀完全,常温下,Ksp[Cr(OH)3]=1×10-32.有关叙述中不正确的是( )
CrO42-$\stackrel{H+}{→}$Cr2O72-$\stackrel{Fe_{2}+}{→}$Cr3+$\stackrel{OH-}{→}$Cr(OH)3
已知废水中Cr的含量为26.0g•L-1,当溶液中离子浓度小于10-5mol/L时认为离子已经沉淀完全,常温下,Ksp[Cr(OH)3]=1×10-32.有关叙述中不正确的是( )
| A. | 上述三个转化中只有一个涉及氧化还原反应 | |
| B. | 第二步离子方程式为:Cr2O72-+14H++6Fe2+=2Cr3++7H2O+6Fe3+ | |
| C. | 处理含铬废水可使用强碱Ba(OH)2,也可以使用弱碱氨水 | |
| D. | 当pH≥5时,废水中铬元素沉淀完全 |