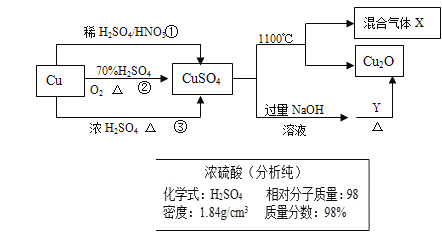
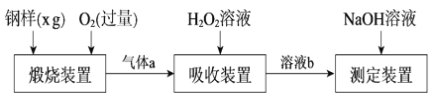
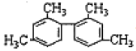
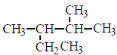题目内容
【题目】位于短周期的四种主族元素A、B、C、D,原子序数依次增大,已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。E是我国使用最早合金中的主要成分。根据你的推断完成下列问题:
(1)B、C、E的元素符号为________,________,__________。
(2)写出由上述元素形成的具有漂白作用的四种物质的化学式______、______、______、______。
(3)由A、B两种元素形成的原子个数比为1∶1的化合物的电子式______。
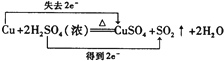
(4)写出D的最高价氧化物对应水化物与E反应的化学方程式,并用双线桥标出电子转移的方向和数目___。
【答案】O Na Cu SO2 O3 H2O2 Na2O2 ![]()
【解析】
A在周期表中的原子半径最小,说明A为氢;位于短周期的的四种同族元素A、B、C、D,原子序数依次增大,已知A、C位于同一主族,说明C为钠,B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍,A、C的原子序数之和为1+11=12,则B、D的原子序数之和=2×12=24,设B、D最外层电子数为x,B的原子序数=2+x,D的原子序数=2+8+x,则2+X+2+8+X=24,X=6,说明B为氧、D为硫;E是我国使用最早合金中的主要成分,E为Cu。
(1)B、C、E的元素符号为O、Na、Cu;
(2)由上述元素形成的具有漂白作用的四种物质的化学式分别为SO2、O3、H2O2、Na2O2;
(3) 由A、B两种元素形成的原子个数比为1∶1的化合物为过氧化氢,电子式为![]() ;
;
(4)D的最高价氧化物对应水化物与E反应,是浓硫酸和Cu单质的反应,方程式为![]() ,用双线桥标出电子转移的方向和数目为
,用双线桥标出电子转移的方向和数目为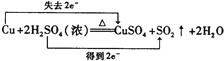 。
。

 中考解读考点精练系列答案
中考解读考点精练系列答案