题目内容
【题目】X、Y、Z、L、M为原子序数依次增大的短周期元素。X原子半径最小、Y元素形成化合物种类最多、Z元素的氢化物水溶液呈碱性、常温下L可以形成两种液态氢化物,M的最高价氧化物对应的水化物呈两性。回答下列问题:
(1)L元素形成单质的名称为____________;M在元素周期表中的位置为_________;五种元素的原子半径从大到小的顺序是______________(用元素符号表示)。
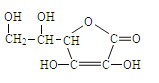
(2)Z、X两元素按原子数目比1:3和2:4构成分子A和B,A的电子式为_________,B的结构式为__________。
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为_______________。
(4)写出由X、Z、L三种元素组成的离子化合物与NaOH溶液加热反应的离子方程式为____________________________________________。
【答案】(1)氧气、臭氧 (1分)第三周期第IIIA族(1分)
Al>C>N>O>H(写M>Y>Z>L>X不给分)(1分)
![]() (2分)
(2分)
(3)34(2分)
(4)NH4++OH—![]() NH3↑+H2O(1分)
NH3↑+H2O(1分)
【解析】试题分析:X、Y、Z、L、M为原子序数依次增大的短周期元素.周期表中X原子半径最小,则X为H元素;Y元素形成化合物种类最多,则Y为C元素;Z元素的氢化物水溶液呈碱性,则Z为N元素;常温下L可以形成两种液态氢化物,则L为O元素;M的最高价氧化物对应的水化物呈两性,则M为Al。(1)L为O元素,形成的单质为氧气、臭氧;M为Al元素,处于第三周期ⅢA族;H原子半径最小,同周期水原子序数增大原子半径减小,同主族自上而下原子半径增大,故原子半径Al>C>N>O>H,故答案为:氧气、臭氧;第三周期ⅢA族;Al>C>N>O>H;(2)N、H两元素按原子数目比1:3和2:4构成分子A和B,则A为NH3、B为N2H4,NH3分子中N原子与H原子之间形成1对共用电子对,其电子式为:![]() ,N2H4分子中N原子之间形成1对共用电子对、N原子与H原子之间形成1对共用电子对,其结构式为:
,N2H4分子中N原子之间形成1对共用电子对、N原子与H原子之间形成1对共用电子对,其结构式为:![]() ,故答案为:
,故答案为:![]() ;
;![]() ;(3)硒(Se)是人体必需的微量元素,与O元素为同一主族,Se原子比L原子多两个电子层,则Se的原子序数=8+8+18=34,
;(3)硒(Se)是人体必需的微量元素,与O元素为同一主族,Se原子比L原子多两个电子层,则Se的原子序数=8+8+18=34,
故答案为:34;(4)由H、N、O三种元素组成的离子化合物为NH4NO3,与稀的NaOH溶液加热反应的离子方程式为:NH4++OH—![]() NH3↑+H2O。
NH3↑+H2O。