题目内容
【化学与技术】
以黄铁矿为原料(主要成分是FeS2)为原料,生产硫酸的简要流程图如下:
(1)写出流程图中一种氧化物的名称 。
(2)将黄铁矿粉碎,目的是 。
(3)流程中SO2转化为SO3的化学方程式为 。
(4)炉渣(Fe2O3)在工业上可用来 。
(1)二氧化硫或三氧化硫或三氧化二铁
(2)增大反应物的接触面积
(3)
(4)做冶铁原料
解析

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列关于硅元素的说法,不正确的是
| A.光导纤维的主要成分是二氧化硅 | B.二氧化硅可以和水直接反应来制取硅酸 |
| C.硅可用作太阳能电池 | D.硅酸钠是制备硅胶和木材防火剂等的原料 |
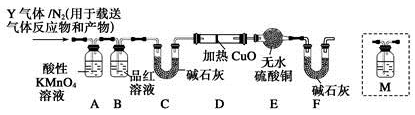
 H++Cl-+ HClO,其平衡常数表达式为K= 。
H++Cl-+ HClO,其平衡常数表达式为K= 。