题目内容
(15分)二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。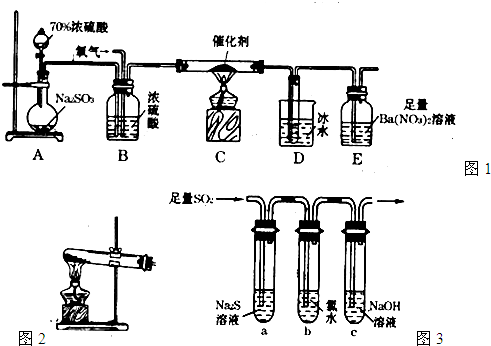
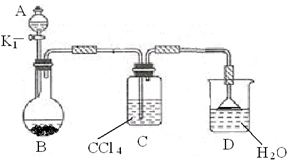
(1)实验室用图1装置测定SO2催化氧化为SO3的转化率。(已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。)
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作: 。
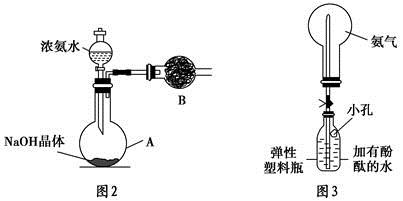
②实验过程中,需要通入氧气。试写出一个用如图2所示装置制取氧气的化学方程式: 。
③当停止通入SO2熄灭酒精灯后,需要继续通一段时间的氧气,其目的是: 。
④实验结束后,若装置D增加的质量为mg,装置E中产生白色沉淀的质量为ng,则此
条件下二氧化硫的转化率是 (用含字母的代数式表示,不用化简)。
(2)某学习小组设计用如图3装置验证二氧化硫的化学性质。
①能说明二氧化硫具有氧化性的实验现象为: 。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分三份,分别进行如下实验。
方案I:向第一份溶液中加入AgNO3溶液,有白色沉
淀生成。
方案II:向第二份溶液中加入品红溶液,红色褪去。
方案III:向第三份溶液中加入BaC12溶液,产生白色沉淀
上述方案中合理的是 (填“I”、“II”、或“III”);
试管b发生反应的离子方程式: 。
③当通入二氧化硫至试管c中溶液显中性时,该溶液中
c(Na+)= (用含硫微粒浓度的代数式表示)。
(除说明外其余2分,共15分)
(1) ①打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,缓慢滴加。
②2KClO3 2KCl+3O2 或2KMnO4
2KCl+3O2 或2KMnO4 K2MnO4+MnO2+O2
K2MnO4+MnO2+O2
③使残留在装置中的二氧化硫和三氧化硫被充分吸收。
④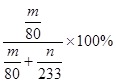
(2)①试管a中出现淡黄色浑浊
②Ⅲ合理(1分), SO2+Cl2+2H2O=4H++SO42-+2Cl-
③ 2 C(SO32-)+ C(HSO3-)
解析试题分析:(1)①用分液漏斗向圆底烧瓶中滴加浓硫酸的操作打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,缓慢滴加;
②图2为加热固体制取气体的装置,所以用该装置制取氧气可以用2KClO3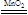 2KCl+3O2 也可以用 2KMnO4
2KCl+3O2 也可以用 2KMnO4 K2MnO4+MnO2+O2
K2MnO4+MnO2+O2
③为确保实验的准确度,要保证二氧化硫和三氧化硫的量的测定准确,当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,可以让装置中的二氧化硫和三氧化硫充分被后面的装置吸收;
④装置D增加的质量为mg,及生成三氧化硫的质量是mg,物质的量是mg/80g/mol,装置E 中产生白色沉淀为硫酸钡沉淀,质量为ng,则吸收的二氧化硫的物质的量是ng/233g/mol,根据元素守恒,则二氧化硫的转化率=mg/80g/mol/(mg/80g/mol+ng/233g/mol)×100%=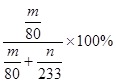 ;
;
(2)①二氧化硫与硫化钠溶液反应生成淡黄色的单质硫,证明二氧化硫有氧化性,所以能说明二氧化硫具有氧化性的实验现象为试管a中出现淡黄色浑浊
②二氧化硫与氯水反应生成硫酸根离子和氯离子,所以方案I:溶液中存在氯离子产生的白色沉淀不能证明是硫酸银沉淀,所以不能证明溶液中存在硫酸根离子,错误;方案II:使品红溶液褪色只能证明b溶液中含有未完全反应的次氯酸,不能证明有硫酸根离子,错误;方案III:与钡离子反应生成沉淀的在b溶液中只能是硫酸根离子,证明b溶液中存在硫酸根离子,说明二氧化硫被氧化,具有还原性,所以方案III合理;试管b发生反应的离子方程式:SO2+Cl2+2H2O=4H++SO42-+2Cl-
③二氧化硫与氢氧化钠溶液反应生成亚硫酸钠或亚硫酸氢钠或二者都有,溶液呈中性,说明c(H+)= c(OH-),根据电荷守恒规律,所以c(Na+)="2" C(SO32-)+ C(HSO3-)。
考点:考查仪器的操作方法,氧气的制取,转化率的计算,二氧化硫的性质验证实验,化学方程式、离子方程式的书写,实验方案的判断

(10分)下图是研究铜与浓硫酸的反应装置: 
(1)A试管中发生反应的化学方程式为 。
(2)反应一段时间后,可观察到B试管中的现象为 。
(3)C试管口浸有NaOH溶液的棉团作用是 。
(4)实验结束后,证明A试管中反应所得产物是否含有铜离子的操作方法是 。
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
| 资料1 |  附表铜与浓硫酸反应产生黑色物质的相关性质 |
| 资料2 | X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。 |
A.铜与浓硫酸反应时所涉及的反应可能不止一个 B.硫酸浓度选择适当,可避免最后产物中出现黑色物质;C.该反应发生的条件之一是硫酸浓度≥15 mol·L D.硫酸浓度越大,黑色物质越快出现、越难消失
碱式碳酸铜和氯气都是用途广泛的化工原料。
(1)工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl?)制备碱式碳酸铜,其制备过程如下: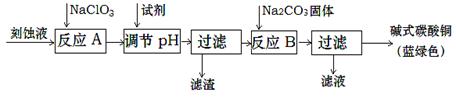
已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
①氯酸钠的作用是 ;
②反应A后调节溶液的pH范围应为 。
③第一次过滤得到的产品洗涤时,如何判断已经洗净? 。
④造成蓝绿色产品中混有CuO杂质的原因是 。
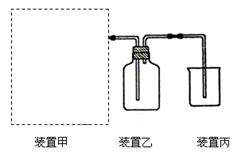
(2)某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。

①实验室用二氧化锰和浓盐酸加热制取氯气,所用仪器需要检漏的有 。
②若C中品红溶液褪色,能否证明氯气与水反应的产物有漂白性,说明原因 。此时B装置中发生反应的离子方程式是___________ _____。
③写出A溶液中具有强氧化性微粒的化学式 。若向A溶液中加入NaHCO3粉末,会观察到的现象是 。


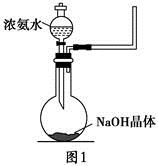

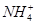 +OH-,NaOH晶体使该可逆反应的平衡向左移动
+OH-,NaOH晶体使该可逆反应的平衡向左移动