题目内容
2.砷(As)广泛分布于自然界,其原子结构示意图是 .
.(1)砷位于元素周期表中VA族,其气态氢化物的稳定性比NH3弱(填“强”或“弱”).
(2)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差.根据下左图写出As2O5分解为As2O3的热化学方程式:As2O5(s)=As2O3(s)+O2(g)△H=+295.4 kJ•mol-1.

(3)砷酸盐可发生如下反应:AsO43-+2I-+2H+?AsO33-+I2+H2O.图2装置中,C1、C2是石墨电极. A中盛有棕色的KI和I2的混合溶液,B中盛有无色的Na3AsO4和Na3AsO3的混合溶液,当连接开关K,并向B中滴加浓盐酸时发现灵敏电流计G的指针向右偏转.此时C2上发生的电极反应是AsO43-+2H++2e-=AsO33-+H2O.
(4)利用(3)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样mg溶于NaOH溶液,得到含AsO43-和AsO33-的混合溶液.As2O5与NaOH溶液反应的离子方程式是As2O5+6OH-═2AsO43-+3H2O.
②上述混合液用0.02500mol•L-1的I2溶液滴定,用淀粉做指示剂,滴定至溶液由蓝色变为无色,停止滴定,记录数据.重复滴定2次,平均消耗I2溶液20.00mL.则试样中As2O5的质量分数是$\frac{0.0575}{m}$.
分析 (1)最外层有5个电子,由同主族位置和元素周期律可知,非金属性N>As;
(2)As2O5分解为As2O3需要吸收的热量为-619kJ/mol-(-914.6kJ/mol)=+295.4 kJ•mol-1,以此书写热化学方程式;
(3)发生AsO43-+2I-+2H+?AsO33-+I2+H2O,C1棒为负极,发生2I--2e-=I2,C2为正极发生还原反应;
(4)①根据As2O5与NaOH溶液反应生成盐和水书写离子方程式;
②混合液用0.02500mol•L-1的I2溶液滴定,消耗I2溶液20.00mL,根据AsO33-+I2+H2O═AsO43-+2I-+2H+,As2O5+6OH-═2AsO43-+3H2O,由As2O5~2AsO43-~2I2计算.
解答 解:(1)最外层有5个电子,则As位于第ⅤA族,由同主族位置和元素周期律可知,非金属性N>As,则As的气态氢化物的稳定性比NH3弱,
故答案为:ⅤA;弱;
(2)由图象可知,As2O5分解为As2O3需要吸收的热量为-619kJ/mol-(-914.6kJ/mol)=+295.4 kJ•mol-1,则热化学方程式As2O5(s)=As2O3(s)+O2(g)△H=+295.4 kJ•mol-1,
故答案为:As2O5(s)=As2O3(s)+O2(g)△H=+295.4 kJ•mol-1;
(3)B中滴加浓盐酸时发生AsO43-+2I-+2H+?AsO33-+I2+H2O,A中C1棒为负极,发生2I--2e-=I2,C2为正极发生还原反应,电极反应为AsO42-+2H++2e-=AsO33-+H2O,
故答案为:AsO42-+2H++2e-=AsO33-+H2O;
(4)①因为As2O5为碱性氧化物,与NaOH溶液反应生成盐和水,所以离子方程式为:As2O5+6OH-═2AsO43-+3H2O,
故答案为:As2O5+6OH-═2AsO43-+3H2O;
②用I2溶液滴定可以用淀粉溶液作指示剂,当溶液由蓝色变为无色时说明达到滴定终点;
上述混合液用0.02500mol•L-1的I2溶液滴定,消耗I2溶液20.00mL,根据AsO33-+I2+H2O═AsO43-+2I-+2H+,As2O5+6OH-═2AsO43-+3H2O,
As2O5 ~2AsO43-~2I2
1 2
n 0.02500mol•L-1×20.00×10-3L
则n=2.5×10-4mol,
所以m(As2O5)=2.5×10-4mol×230g/mol=0.0575 g,
所以质量分数为$\frac{0.0575}{m}$;
故答案为:淀粉;溶液由蓝色变为无色;$\frac{0.0575}{m}$.
点评 本题考查较综合,涉及元素的位置及元素周期律、热化学方程式、原电池的工作原理等,注重高考高频考点的考查,侧重学生分析能力及知识迁移应用能力的考查,(4)为解答的难点,注意利用反应方程式中各物质之间的关系计算,题目难度中等.

| A. | 特氟隆(聚四氟乙烯)的单体是氟利昂 | |
| B. | 蛋白质是由氨基酸形成的可水解的高分子化合物,其水溶液有丁达尔现象 | |
| C. | 聚丙烯的结构简式为: | |
| D. | 石英的化学式为CaSiO3 |
| A. | ${\;}_{8}^{16}$O、${\;}_{8}^{18}$O为不同的核素,有不同的化学性质 | |
| B. | H2、SO2、NH3三种气体都可用浓硫酸干燥 | |
| C. | 分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 | |
| D. | 陶瓷、玻璃、水泥、大理石的主要成分都是硅酸盐 |
| A. | 0.25mol•L-1 | B. | 0.50mol•L-1 | C. | 0.75mol•L-1 | D. | 1.25mol•L-1 |
| A. | 0.500 mol/L | B. | 1.00 mol/L | C. | 2.00 mol/L | D. | 3.00 mol/L |
 氢能被视作连接化石能源和可再生能源的重要桥梁.
氢能被视作连接化石能源和可再生能源的重要桥梁.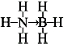 ;与氨硼烷互为等电子体的有机化合物是CH3CH3(写结构简式).
;与氨硼烷互为等电子体的有机化合物是CH3CH3(写结构简式). .
. ;镁条在气体B中燃烧生成的物质是Mg3N2(填化学式);
;镁条在气体B中燃烧生成的物质是Mg3N2(填化学式);