题目内容
7.砷元素的原子序数为33,该元素原子的核外电子排布式是1s22s22p63s23p63d104s24p3,有8个能级(能量不同的轨道).在元素周期表中,砷元素位于第五周期ⅤA族;它的最高价氧化物的化学式为As2O5,砷酸钠的化学式是Na3AsO4.分析 根据构造原理写出As原子核外电子排布式,并判断其含有的能级;N、P、As、Sb、Bi是第ⅤA族元素,最高化合价=最外层电子数=5,同族元素具有相似性,据此写出As的最高价氧化物、砷酸钠的化学式.
解答 解:砷元素的原子序数为33,根据构造原理,As元素原子的核外电子排布式是1s22s22p63s23p63d104s24p3,As原子含有的能级为:1s、2s、2p、3s、3p、3d、4s、4p,总共有8个能级;
N、P、As、Sb、Bi是第ⅤA族元素,在周期表中位于第五周期第ⅤA族,最高化合价=最外层电子数=5,最高价氧化物的化学式为As2O5,根据磷酸钠的化学式Na3PO4可以知砷酸钠的化学式为Na3AsO4,
故答案为:1s22s22p63s23p63d104s24p3;五;ⅤA;As2O5;Na3AsO4.
点评 本题考查了元素周期表结构及其应用,题目难度中等,明确元素周期表结构、元素周期律内容为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列分离提纯物质的操作中,错误的是( )
| A. | 用过滤的方法除去食盐中的泥沙 | |
| B. | 用渗析的方法除去淀粉中的氯离子 | |
| C. | 用结晶的方法分离氯化钠和硝酸钾 | |
| D. | 用分液的方法除去四氯化碳中混有的溴 |
15. 将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )
将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )
 将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )
将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )| A. | O点溶液中所含溶质的化学式为NaOH、Na2CO3 | |
| B. | 常温下,a点溶液pH>7 | |
| C. | 标准状况下,通入CO2的体积为4.48L | |
| D. | 原NaOH溶液的物质的量浓度为2.5mol/L |
12.能表示阿伏加德罗常数数值的是( )
| A. | 1mol金属钠含有的电子数 | |
| B. | 1L 1mol/L硫酸溶液所含的H+数 | |
| C. | 标准状况下,22.4L四氯化碳所含的分子数 | |
| D. | 0.012kg12C所含的原子数 |
19.按照物质的树状分类和交叉分类,硫酸应属于( )
①酸 ②能导电 ③含氧酸 ④混合物 ⑤化合物 ⑥二元酸 ⑦强电解质.
①酸 ②能导电 ③含氧酸 ④混合物 ⑤化合物 ⑥二元酸 ⑦强电解质.
| A. | ①②③④⑦ | B. | ①③⑤⑥⑦ | C. | ①③④⑥⑦ | D. | ②③⑤⑥⑦ |

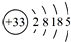 .
.
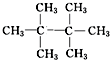
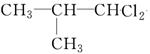 、
、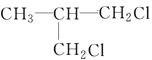 、
、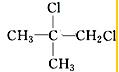 .
.