题目内容
17.A、B、C、D四种短周期元素,A元素的一种同素异形体是自然界硬度最大的单质,C与A同主族,C元素的原子序数是B的2倍,工业上以D元素的单质与石灰乳为原料制造漂白粉.按要求回答下列问题:(1)B的原子结构示意图为
 ;镁条在气体B中燃烧生成的物质是Mg3N2(填化学式);
;镁条在气体B中燃烧生成的物质是Mg3N2(填化学式);(2)A的非金属性强于C,请用一个化学反应方程式表示2CO2+Na2SiO3+2H2O=H2SiO3↓+2NaHCO3或CO2+Na2SiO3+H2O=H2SiO3↓+Na2CO3;
(3)元素B、D形成的化合物BD3能与水反应生成具有漂白性的物质X,写出该反应的化学方程式NCl3+3H2O=3HClO+NH3↑.
分析 A、B、C、D四种短周期元素,A元素的一种同素异形体是自然界硬度最大的单质,则A为碳元素;C与A同主族,则C为Si;C元素的原子序数是B的2倍,则B为N元素;工业上以D元素的单质与石灰乳为原料制造漂白粉,则D为Cl,据此解答.
解答 解:A、B、C、D四种短周期元素,A元素的一种同素异形体是自然界硬度最大的单质,则A为碳元素;C与A同主族,则C为Si;C元素的原子序数是B的2倍,则B为N元素;工业上以D元素的单质与石灰乳为原料制造漂白粉,则D为Cl.
(1)B为N元素,原子结构示意图为 ,镁条在气体B中燃烧生成的物质是:Mg3N2,
,镁条在气体B中燃烧生成的物质是:Mg3N2,
故答案为: ;Mg3N2;
;Mg3N2;
(2)碳的非金属性强于Si,可以利用最高价含氧酸的酸性强弱比较,相应方程式为:2CO2+Na2SiO3+2H2O=H2SiO3↓+2NaHCO3或CO2+Na2SiO3+H2O=H2SiO3↓+Na2CO3,
故答案为:2CO2+Na2SiO3+2H2O=H2SiO3↓+2NaHCO3或CO2+Na2SiO3+H2O=H2SiO3↓+Na2CO3;
(3)元素B、D形成的化合物NCl3能与水反应生成具有漂白性的物质X,X为HClO,则有NH3生成,该反应的化学方程式为:NCl3+3H2O=3HClO+NH3↑,
故答案为:NCl3+3H2O=3HClO+NH3↑.
点评 本题考查结构性质位置关系应用,侧重考查学生对基础知识的掌握与迁移运用能力,难度中等.

练习册系列答案
相关题目
8.少量铁粉与100mL 0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸④加NaCl溶液
⑤改用10mL 0.1mol/L的盐酸⑥滴加几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸④加NaCl溶液
⑤改用10mL 0.1mol/L的盐酸⑥滴加几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)
| A. | ①⑥⑦ | B. | ③⑤⑦ | C. | ①④⑦ | D. | ③⑥⑦ |
9. 一种碳纳米管能够吸附氢气,用这种材料吸氢后制备的二次电池(充放电电池)工作原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )
一种碳纳米管能够吸附氢气,用这种材料吸氢后制备的二次电池(充放电电池)工作原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )
 一种碳纳米管能够吸附氢气,用这种材料吸氢后制备的二次电池(充放电电池)工作原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )
一种碳纳米管能够吸附氢气,用这种材料吸氢后制备的二次电池(充放电电池)工作原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )| A. | 放电时K+移向碳电极 | |
| B. | 放电时电池负极的电极反应为H2-2e-═2H+ | |
| C. | 充电时镍电极的电极反应为:Ni(OH)2+OH--e-═NiO(OH)+H2O | |
| D. | 该电池充电时将碳电极与电源的正极相连,发生氧化反应 |
6.下列离子在溶液中能大量共存的是( )
| A. | Fe3+、Al3+、SCN-、Cl- | B. | Na+、Ca2+、HCO3-、Cl- | ||
| C. | Fe3+、Na+、S2-、Cl- | D. | K+、H+、Cl-、AlO2- |
7.下列物质中,属于同系物的是( )
| A. | 硬脂酸与软脂酸(C15H31COOH) | B. | HCHO与CH3COOH | ||
| C. | CH2=CHCOOH与CH3CH2CH2COOH | D. | 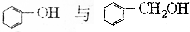 |
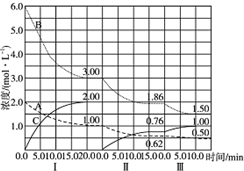 反应:aA(g)+bB(g)$\stackrel{催化剂}{?}$cC(g)(△H<0)在等容条件下进行.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图示:
反应:aA(g)+bB(g)$\stackrel{催化剂}{?}$cC(g)(△H<0)在等容条件下进行.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图示:


 .
.