题目内容
12.钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一.Ⅰ.如图1装置中,U形管内为红墨水,a、b试管内分别盛有氯化铵(显酸性)溶液和食盐水,各加入生铁块,放置一段时间均被腐蚀,这两种腐蚀都属于电化学腐蚀.
(1)红墨水柱两边的液面变为左低右高,则b(填“a”或“b”)边盛有食盐水.
(2)b试管中铁发生的是吸氧腐蚀,生铁中碳上发生的电极反应式O2+2H2O-4e-=4OH-;b试管中铁被腐蚀的总化学方程式为2Fe+O2+2H2O=2Fe(OH)2.
Ⅱ.如图2两个图都是金属防护的例子.
(1)为了降低某水库的铁闸门被腐蚀的速率,可以采用图2甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用C(从下面选项中选择),此方法叫做牺牲阳极的阴极保护法.
A.铜 B.钠 C.锌 D.石墨
(2)图2乙方案也可以降低铁闸门腐蚀的速率,其中铁闸门应该连接在直流电源的负极.
(3)采取以上两种方法,乙(填“甲”或“乙”)种能使铁闸门保护得更好.
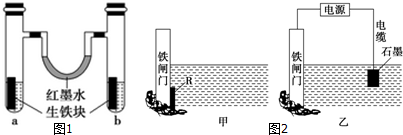
分析 Ⅰ.生铁中含有碳杂质,在电解质环境下,铁发生电化学腐蚀,若溶液呈酸性则发生析氢腐蚀,若溶液呈中性则发生吸氧腐蚀,左边试管中是中性溶液,发生吸氧腐蚀,右边试管中是酸性溶液发生析氢腐蚀,据此解答;
Ⅱ.(1)原电池的负极金属易被腐蚀,根据原电池的工作原理来回答;
(2)在电解池的阴极上的金属被保护,根据电解池的工作原理来回答;
(3)电解池的保护比原电池保护更好判断.
解答 解:Ⅰ.生铁中含有碳杂质,在电解质环境下,铁发生电化学腐蚀;故答案为:电化学;
(1)红墨水柱两边的液面变为左低右高,则a发生析氢腐蚀,b发生吸氧腐蚀,所以b边盛有食盐水,故答案为:b;
(2)b试管中铁发生的是吸氧腐蚀,生铁中碳上发生的电极反应式O2+2H2O-4e-=4OH-;负极发生氧化反应,电极反应式为:Fe-2e-=Fe2+,所以b试管中铁被腐蚀的总化学方程式为2Fe+O2+2H2O=2Fe(OH)2;故答案为:吸氧;O2+2H2O-4e-=4OH-;2Fe+O2+2H2O=2Fe(OH)2;
Ⅱ.(1)为了降低某水库的铁闸门被腐蚀的速率,可以让金属铁做原电池的正极,其中焊接在铁闸门上的固体材料R可以是比金属铁的活泼性强的金属,钠不能做电极材料,所以选锌,此方法叫做牺牲阳极的阴极保护法,故答案为:C;牺牲阳极的阴极;
(2)电解池的阴极上的金属被保护,为降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的负极,故答案为:负;
(3)因为电解池的保护比原电池保护更好,所以乙种能使铁闸门保护得更好;
故答案为:乙.
点评 本题考查了金属的腐蚀与防护,明确原电池和电解池原理是解本题关键,知道作原电池负极和电解池阳极的金属易被腐蚀,难度不大.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
3.某混合气体由两种气态烃组.标准状况下,2.24L 该混合气体完全燃烧后,得到3.36L二氧化碳气体(标准状况)和3.6g水.下列说法中正确的是( )
| A. | 混合气体中一定含有甲烷 | B. | 混合气体一定是甲烷和乙烯 | ||
| C. | 混合气体中一定含有乙烷 | D. | 混合气体可能是甲烷和乙烯 |
20.下列化学反应一定属于放热反应的是( )
| A. | Ba(OH)2•8H2O与NH4C1反应 | B. | 水解反应 | ||
| C. | 醋酸的电离 | D. | 盐酸与NaOH溶液的反应 |
7.下列物质中,属于同系物的是( )
| A. | 硬脂酸与软脂酸(C15H31COOH) | B. | HCHO与CH3COOH | ||
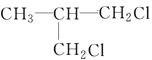
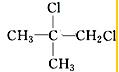
| C. | CH2=CHCOOH与CH3CH2CH2COOH | D. |  |
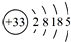 .
.
 、
、 、
、 .
.