题目内容
19.下列物质中,既能与盐酸反应又能与NaOH溶液反应的是( )①Ca(HCO3)2 ②Al(OH)3 ③NaAlO2 ④(NH4)2S ⑤Al.
| A. | ①② | B. | ②③⑤ | C. | ①②④⑤ | D. | 全部 |
分析 Al、Al(OH)3、Al2O3、弱酸酸式盐、弱酸的铵盐、蛋白质、氨基酸等物质都能和稀盐酸、NaOH溶液反应,据此分析解答.
解答 解:Al、Al(OH)3、Al2O3、弱酸酸式盐、弱酸的铵盐、蛋白质、氨基酸等物质都能和稀盐酸、NaOH溶液反应,
①Ca(HCO3)2属于弱酸酸式盐,能和HCl、NaOH溶液反应,故正确;
②Al(OH)3属于两性氢氧化物,能和HCl、NaOH溶液反应,故正确;
③NaAlO2属于弱酸强碱盐,能和HCl反应但和NaOH溶液不反应,故错误;
④(NH4)2S属于弱酸的铵盐,能和HCl、NaOH溶液反应,故正确;
⑤Al能和HCl、NaOH溶液反应生成铝盐和氢气,故正确;
故选C.
点评 本题以铝及其化合物的性质为载体考查两性物质,明确物质的性质是解本题关键,注意总结归纳元素化合物知识,题目难度不大.

练习册系列答案
相关题目
10.几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 102 | 74 |
| 主要化合价 | +2 | +3 | +6、+4、-2 | -2 |
| A. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| B. | 气态氢化物的稳定性H2Z<H2W | |
| C. | X、Y元素的金属性X<Y | |
| D. | 一定条件下,Z单质与W的常见单质直接生成ZW3 |
14.15C-NMR(核磁共振)可用于含碳化合物的结构分析14N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,下面有关13C、15N叙述正确的是( )
| A. | 13C与15N具有相同的中子数 | B. | 13C与C60是同一种物质 | ||
| C. | 15N与14N互为同位素 | D. | 15N的核外电子数与中子数相同 |
4.一种碳纳米管能够吸附氢气,可做二次电池的碳电极(如图所示),该电池的电解质溶液是6mol/L溶液,下列说法中,错误的是( )
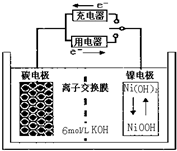

| A. | 充电时碳电极上发生还原反应 | |
| B. | 充电时Ni电极与电源的正极相连 | |
| C. | 放电时碳电极反应为H2-2e-=2H+ | |
| D. | 放电时Ni电极反应为Na(OH)+H2O+e-=Ni(OH)2+OH- |
8.除去下列物质中的杂质选用的试剂和方法最合理的是( )
| 物质 | 杂质 | 试剂 | 方法 | |
| A | 甲烷 | 乙烯 | 酸性高锰酸钾溶液 | 洗气 |
| B | 氯化亚铁溶液 | 氯化铁 | 过量铁粉 | 过滤 |
| C | 苯 | 溴 | 足量NaI溶液 | 分液 |
| D | 乙酸乙酯 | 乙酸 | 饱和碳酸钠溶液 | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
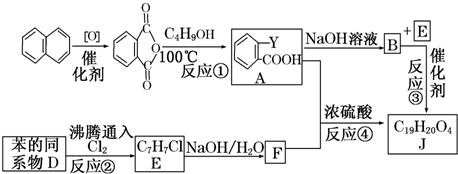
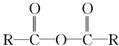 $\stackrel{R′OH}{→}$
$\stackrel{R′OH}{→}$ +
+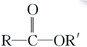
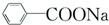 +RCl→
+RCl→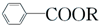 +NaCl
+NaCl .
.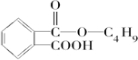 +
+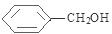 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$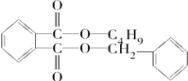 +H2O.
+H2O.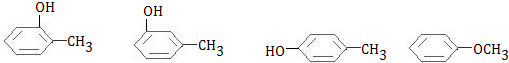 .
. ,晶体类型为分子晶体.
,晶体类型为分子晶体.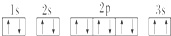 ,该同学所画的电子排布图违背了泡利原理.
,该同学所画的电子排布图违背了泡利原理.


