题目内容
12.设NA为阿伏伽德罗常数,下列叙述正确的是( )| A. | 1mol烃基中电子数为10NA | |
| B. | 标准状况下,11.2L乙醇中含有的分子数为0.5NA | |
| C. | 标准状况下,0.56L丙烷中含有共价键的数目为0.2NA | |
| D. | 0.1mol乙烯和乙醇的混合物完全燃烧所消耗的氧原子数一定为0.6NA |
分析 A、烃基分为甲基、乙基、丙基、丁基等;
B、标况下,乙醇为液态;
C、求出丙烷的物质的量,然后根据1mol丙烷中含10mol共价键来分析;
D、1mol乙烯和1mol乙醇燃烧均消耗3mol氧气.
解答 解:A、烃基分为甲基、乙基、丙基、丁基等,烃基的种类不明确,故含有的电子数不一定是10NA,故A错误;
B、标况下,乙醇为液态,不能根据气体摩尔体积来计算其物质的量,故B错误;
C、标况下,0.56L丙烷的物质的量n=$\frac{0.56L}{22.4L/mol}$=0.025mol,而1mol丙烷中含10mol共价键,故0.025mol丙烷中含0.25mol共价键即0.25NA条,故C错误;
D、1mol乙烯和1mol乙醇燃烧均消耗3mol氧气,故0.1mol乙烯和乙醇的混合物完全燃烧消耗0.3mol氧气,与两者的比例无关,而0.3mol氧气中含0.6mol氧原子即0.6NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.下列各组物质中,属于同分异构体的是( )
| A. | O2与O3 | B. | 正戊烷与异戊烷 | C. | 甲烷与乙烷 | D. | 淀粉与纤维素 |
20.某种有机物的分子模型如图,图中的“棍”代表单键或双键,该模型代表的有机物可能是( )


| A. | 饱和一元醇 | B. | 羟基酸 | C. | 羧酸 | D. | 饱和一元醛 |
7.油脂在NaOH稀溶液中发生皂化反应,可以判断反应基本完成的现象是( )
| A. | 反应液使酚酞试液变红色 | B. | 反应液使蓝色石蕊试纸变红色 | ||
| C. | 有大量固体析出 | D. | 反应后静置,反应液不分层 |
4.结构为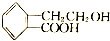 的有机物可以通过不同的反应得到下列五种物质
的有机物可以通过不同的反应得到下列五种物质
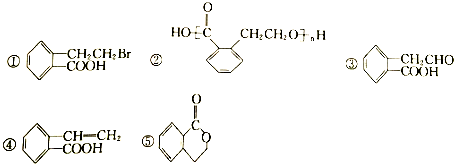
生成这五种有机物的反应类型依次为( )
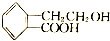 的有机物可以通过不同的反应得到下列五种物质
的有机物可以通过不同的反应得到下列五种物质
生成这五种有机物的反应类型依次为( )
| A. | 取代、加成、氧化、消去、取代 | B. | 取代、取代、还原、消去、酯化 | ||
| C. | 酯化、缩聚、取代、消去、取代 | D. | 取代、缩聚、氧化、消去、酯化 |
1.下列说法正确的是(阿伏加德罗常数的数值为NA)( )
| A. | 水的摩尔质量为18g | |
| B. | 1 mol/L K2SO4溶液所含K+数目为2NA | |
| C. | 在常温常压下,2g氢气的体积为22.4L | |
| D. | 1 mol Mg2+的质量为24g |
2.某锂离子电池的总反应为:Li1-xFePO4+LixC6$?_{充电}^{放电}$C6+LiFePO4,(LixC6表示锂原子嵌入石墨形成的复合材料),其工作原理如图所示.下列说法不正确的是( )

| A. | 放电时,电流从a极经负载后流向b极 | |
| B. | 充电时,Li+向a极移动 | |
| C. | 充电时a极发生的反应为:LiFePO4-xe-=Li1-xFePO4+xLi+ | |
| D. | 放电时,每转移xmol电子,产生1mol C6 |
 目前研究汽车尾气中的NO2处理问题成为重要课题,请完成下列问题
目前研究汽车尾气中的NO2处理问题成为重要课题,请完成下列问题