题目内容
17. 目前研究汽车尾气中的NO2处理问题成为重要课题,请完成下列问题
目前研究汽车尾气中的NO2处理问题成为重要课题,请完成下列问题(1)可以利用反应:NO2+G$\stackrel{催化剂}{→}$N2+H2O+nX( n可以为零)将NO2变成无害的N2,若要求X必须为无污染的物质,则G可以是ad(选填字母)
a.NH3 b.CO2 c.SO2 d.CH3CH2OH
当反应中转移1.2mol电子时,消耗标准状况下NO2的体积为6.72L.
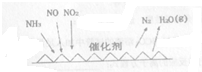
(2)NH3催化还原氨氧化物(SCR)技术是目前应用最广泛的氨氧化物脱除技术,反应原理如图所示.
①SCR技术中的氧化剂为NO2、NO
②当NO2与NO的物质的量之比为1:1时,与足量氨气在一定条件下发生反应,该反应的总化学方程式为2NH3+NO2+NO=2N2+3H2O,当有3mol电子发生转移时,则参与反应的NO的物质的量为0.5mol.
分析 (1)根据氧化还原反应中氧化剂和还原剂的特点结合常见的氧化剂和还原剂来回答,将NO2变成无害的N2中,氮元素的化合价降低了,二氧化氮做氧化剂,需要加入还原剂G,X必须为无污染的物质,结合电子守恒计算消耗标准状况下NO2的体积;
(2)①元素化合价降低得电子做氧化剂,分析元素化合价,化合价降低的反应物是氧化剂;
②NH3中氮的化合价由-3价升高到0价,一个NH3失去3个电子,NO2中氮的化合价由+4价降低到0价,一个NO2得到4个电子,NO中氮的化合价由+2价降低到0价,一个NO得到2个电子,当NO2与NO的物质的量之比为1:1时,转移电子的最小公倍数为6,根据化合价升降总数相等、原子守恒来配平.
解答 解:(1)将NO2变成无害的N2中,氮元素的化合价降低了,二氧化氮做氧化剂,需要加入还原剂,X必须为无污染的物质,在下列四种物质:a.NH3 b.CO2 c.SO2 d.CH3CH2OH中,能被二氧化氮氧化具有还原性的物质有乙醇和NH3,NO2由+4价降低为0价,降低4价,即转移4mol电子,当反应中转移1.2mol电子时,消耗NO2 为0.3mol,体积为6.72L,
故答案为:ad;6.72;
(2)①由图甲可知SCR技术中NH3与NO、NO2反应产物为N2和水,故氧化剂为NO、NO2,故答案为:NO、NO2;
②NH3中氮的化合价由-3价升高到0价,一个NH3失去3个电子,NO2中氮的化合价由+4价降低到0价,一个NO2得到4个电子,NO中氮的化合价由+2价降低到0价,一个NO得到2个电子,当NO2与NO的物质的量之比为1:1时,转移电子的最小公倍数为6,结合质量守恒可知方程式为:2NH3+NO+NO2=2N2+3H2O;每有1molNO反应转移电子6mol,所以有3mol电子发生转移时,生成NO物质的量为0.5mol,
故答案为:2NH3+NO+NO2=2N2+3H2O;0.5mol.
点评 本题考查了氧化还原反应中氧化剂和还原剂判断、氧化还原方程式书写、水解平衡常数计算、弱酸的性质等知识,综合性较强,难度中等.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案| A. | 0.8mol/(L.s) | B. | 2.0mol/(L.s) | C. | 4.0mol/(L.s) | D. | 6.0mol/(L.s) |
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 小苏打与氢氧化钠溶液混合:HCO3-+OH-═CO2↑+H2O | |
| C. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- | |
| D. | 氧化亚铁溶液中加入稀硝酸:3FeO+10H++NO3-═3Fe3++NO↑+5H2O |
| A. | 1mol烃基中电子数为10NA | |
| B. | 标准状况下,11.2L乙醇中含有的分子数为0.5NA | |
| C. | 标准状况下,0.56L丙烷中含有共价键的数目为0.2NA | |
| D. | 0.1mol乙烯和乙醇的混合物完全燃烧所消耗的氧原子数一定为0.6NA |
| A. | 石油分馏和煤的干馏都是化学变化 | |
| B. | 棉与蚕丝完全燃烧都只生成CO2和H2O | |
| C. | 纤维素、蛋白质、油脂、卤代烃在一定条件下都能发生水解反应 | |
| D. | HClO溶液、(NH4)2SO4溶液均能使蛋白质失去生理活性 |
| A. | 6种和6种 | B. | 6种和3种 | C. | 9种和10种 | D. | 9种和5种 |
| A. | SO2具有漂白性 | B. | 溴具有氧化性 | C. | SO2具有氧化性 | D. | 溴具有挥发性 |

