题目内容
等体积的硫酸钠、硫酸镁、硫酸铝溶液分别于足量氯化钡溶液反应,若生成硫酸钡的质量相等,则三种硫酸盐的物质的量浓度之比为
| A.3:3:1 | B.6:3:2 | C.3:2:1 | D.1:1:1 |
A
解析试题分析:生成硫酸钡的质量相等,根据硫酸根守恒可得,三中物质提供的硫酸根相等。设硫酸钠的物质的量为a mol、硫酸镁的物质的量为b mol、硫酸铝的物质的量为c mol,则有a=b=3c,a:b:c=3:3:1,所以A正确。
考点:考查物质的量的相关计算。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各组物质中分子数相同的是
| A.2LCO和2LCO2 |
| B.9gH2O和标准状况下11.2LCO2 |
| C.标准状况下1molO2和22.4LH2O |
| D.0.2molH2和4.48LHCl气体 |
NA为阿伏伽德罗常数的值。下列叙述正确的是
| A.将28 g Fe投人到1 Ll mol/L的硫酸中,可得到11.2 LH2 |
| B.常温常压下,64 gSO2气体含有的原子数目为3 NA |
| C.25℃时pH =13的NaOH溶液中含有OH一的数目为0. 1 NA |
| D.1 mo1N a被完全氧化生成Na2O2,失去2 NA个电子 |
下列物质的电子式书写正确的是
A.N2: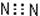 |
B.CO2: |
C.Na2O: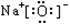 |
D.HCl: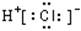 |
我市大纵湖风景区被称为天然氧吧,其原因是空气中的自由电子附着在分子或原子上形成空气负离子,被称为“空气维生素”。O2-就是一种空气负离子,其摩尔质量为
| A.33 g | B.32 g | C.33 g·molˉ1 | D.32 g·molˉ1 |
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.分子数为NA的CO、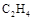 混合气体体积约为22.4L,质量为28g 混合气体体积约为22.4L,质量为28g |
| B.常温常压下,92g的NO2和N2O4混合气体含有的原子数为4NA |
| C.常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为2NA |
D.78g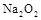 固体与H2O完全反应转移的电子数为NA 固体与H2O完全反应转移的电子数为NA |
用NA表示阿伏加德罗常数的值。下列叙述正确的是w.
A.25℃时,PH=13的1.0L Ba(OH)2溶液中含有的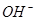 数目为0.2NA 数目为0.2NA |
| B.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |
| C.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA |
| D.标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA |
下列说法正确的是(NA表示阿伏加德罗常数的值)
| A.常温常压下,18g NH4+所含的电子数为10NA |
| B.56g金属铁与氯气反应时得到的电子数为3NA |
| C.标准状态下,22.4L氧气所含的氧原子数为2 NA |
| D.1 mol由Na2O2和Na2O组成的混合物,其中的钠离子数为4 NA |
将铁、铝、硅的混合物分为等质量的两份,一份跟足量的NaOH溶液反应,另一份跟足量稀硫酸反应,最终产生的H2一样多,则铁与硅的物质的量之比为( )
| A.2:1 | B.4:1 | C.1:1 | D.3:1 |