题目内容
将铁、铝、硅的混合物分为等质量的两份,一份跟足量的NaOH溶液反应,另一份跟足量稀硫酸反应,最终产生的H2一样多,则铁与硅的物质的量之比为( )
| A.2:1 | B.4:1 | C.1:1 | D.3:1 |
A
解析试题分析:铁、铝、硅的混合物跟足量的NaOH溶液反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑. Si+2NaOH+H2O= NaSiO3+2H2↑. 铁、铝、硅的混合物跟足量的HCl溶液反应:2Al+6HCl=AlCl3+3H2↑. Fe+2HCl=FeCl2+ H2↑.可见铝与酸反应和铝与碱反应产生的氢气体积相等。故硅与碱反应产生的氢气与铁遇酸反应产生的氢气体积相等。由方程式可知n(Fe):n(Si)=2:1.选项为;A .
考点:考查铁、铝、硅的化学性质的知识。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
等体积的硫酸钠、硫酸镁、硫酸铝溶液分别于足量氯化钡溶液反应,若生成硫酸钡的质量相等,则三种硫酸盐的物质的量浓度之比为
| A.3:3:1 | B.6:3:2 | C.3:2:1 | D.1:1:1 |
下列能表示阿伏加德罗常数数值的是
| A.1molH2含有的电子数 | B.通常状况下,22.4LCO2所含的分子数 |
| C.0.012kg12C所含的原子数 | D.1LO.5mol·L-1的CaCl2溶液所含的Cl-数 |
设NA表示阿伏伽德罗常数的数值,下列说法中正确的是
| A.0.5mol?L-1 Fe2(SO4)3溶液中含有SO42-数为1.5NA |
| B.7.8g Na2O2溶于水后,所得溶液中含有O22-数为NA |
| C.标准状况下,22.4LCl2与足量的铁粉反应,转移的电子数为3NA |
| D.常温常压下,7.0g乙烯和丙烯的混合物中含有氢原子的数目为NA |
设NA为阿伏加德罗常数。下列说法正确的是
| A.1L 1mol·L-1的NaClO 溶液中含有ClO-的数目为NA |
| B.1mol Mg在空气中燃烧被完全氧化生成MgO和Mg3N2,失去2 NA个电子 |
| C.标准状况下,22.4L苯含有1 NA个苯分子 |
| D.1mol的羟基与1mol的氢氧根离子所含电子数均为9 NA |
能正确表示下列反应的化学方程式是
A.黄铁矿煅烧:2FeS2+5O2  2FeO+4SO2 2FeO+4SO2 |
B.石英与石灰石共熔:SiO2+CaO CaSiO3 CaSiO3 |
C.氨的催化氧化:4NH3+5O2  4NO+6H2O 4NO+6H2O |
| D.氯气与石灰乳反应:2Cl2+2Ca(OH)2=CaCl3+CaClO2+2H2O |
38.4mg Cu跟适量的浓HNO3反应,Cu全部作用后,在标准状况下收集到22.4mL(不考虑NO2部分聚合成N2O4),则消耗HNO3的物质的量( )
| A.1.0×10—3mol | B.1.6×10-3mol | C.2.2×10—3mol | D.2.4×10—3mol |
NA为阿伏加德罗常数的值。下列叙述正确的是( )
| A.1.0 L 1.0 mol·L-1的NaAlO2水溶液中含有的氧原子数为2NA |
| B.1 mol醋酸的质量与NA个醋酸分子的质量一定相等 |
| C.2.24 L CO2中含有的原子数为0.3 NA |
D.0.1mol/L 的NaCl溶液中,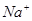 与 与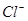 离子总数为0.2NA 离子总数为0.2NA |
NA表示阿伏加德罗常数,下列说法正确的是:
| A.2 mol·L-1的Na2SO4溶液中含有4NA个Na+ |
| B.18克水所含的电子数为10NA |
| C.在标准状况下,11.2L氖气中含有NA个氖原子 |
| D.NA个水分子的相对分子质量之和等于水的摩尔质量 |