题目内容
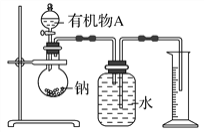
【题目】硫酸镍铵[(NH4)xNiy(SO4)m·nH2O]可用于电镀、印刷等领域。某同学为测定硫酸镍铵的组成,进行如下实验:①准确称取2. 3350 g 样品,配制成100. 00 mL 溶液A;②准确量取25. 00 mL 溶液A,用0. 04000 mol·L-1 的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+),消耗EDTA 标准溶液31. 25 mL;③另取25. 00 mL溶液A,加足量的NaOH 溶液并充分加热,生成NH356. 00 mL(标准状况)。
(1)若滴定管在使用前未用EDTA 标准溶液润洗,测得的Ni2+含量将_________(填“偏高”、或“偏低”或“不变”)。
(2)氨气常用__________________检验,现象是________________。
(3)通过计算确定硫酸镍铵的化学式(写出计算过程)。________
【答案】偏高 湿润的红色石蕊试纸 试纸颜色由红变蓝 n(Ni2+)=0.04000 mol·L-1×31. 25 mL×10-3L·mL-1=1.250×10-3mol
n(NH4 +)=n(NH3)=![]() =2.500×10-3mol
=2.500×10-3mol
根据电荷守恒,n(SO42-)=![]() =
=![]() =2.500×10-3mol
=2.500×10-3mol
m(Ni2+)=59 g·mol-1×1. 250×10-3mol=0.07375 g
m(NH4+)=18g·mol-1×2. 500×10-3mol=0.04500 g
m(SO42-)=96g·mol-1×2. 500×10-3mol=0.2400 g
n(H2O)=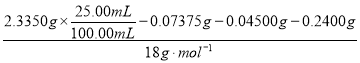 =1.250×10-2mol
=1.250×10-2mol
x :y :m:n= n(NH4+):n(Ni2+):n(SO42-):n(H2O)=2:1:2:10
硫酸镍铵的化学式为(NH4)2Ni(SO4)2·10H2O
【解析】
(1)若滴定管在使用前未用EDTA标准液润洗,EDTA标准液的浓度就会偏低,则滴定消耗的EDTA标准液的体积偏大,测得的Ni2+含量将偏高。
(2)氨气的检验有两种常用的方法:①湿润的红色石蕊试纸,现象是试纸由红色变为蓝色;②浓盐酸,现象是用玻璃棒蘸取浓盐酸,靠近待测气体,产生白烟。
(3)25.00mL溶液中
n(Ni2+)=0.04000 mol·L-1×31. 25 mL×10-3L·mL-1=1.250×10-3mol
n(NH4+)=n(NH3)=![]() =2.500×10-3mol
=2.500×10-3mol
根据电荷守恒,n(SO42-)=![]() =
=![]() =2.500×10-3mol
=2.500×10-3mol
m(Ni2+)=59 g·mol-1×1. 250×10-3mol=0.07375 g
m(NH4+)=18g·mol-1×2. 500×10-3mol=0.04500 g
m(SO42-)=96g·mol-1×2. 500×10-3mol=0.2400 g
n(H2O)=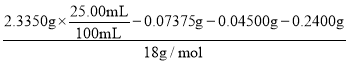 =1.250×10-2mol
=1.250×10-2mol
x:y:m:n= n(NH4+):n(Ni2+):n(SO42-):n(H2O)=2:1:2:10
硫酸镍铵的化学式为(NH4)2Ni(SO4)2·10H2O