题目内容
18.25℃的四种溶液:①pH=2的CH3COOH溶液②pH=2的HCl溶液③pH=12的氨水④pH=12的NaOH溶液,有关上述溶液的说法,正确的是( )| A. | ①、④溶液中水电离的c( H+):①>④ | |
| B. | 将②、③溶液混合后pH=7,则消耗溶液的体积:②<③ | |
| C. | 分别向等体积的上述溶液中加入100 ml,水,溶液的pH:③>④>①>② | |
| D. | 将①、④溶液混合后pH=8,则c(Na+)-c(CH3COO-)=9.9×10-7mol•L-1 |
分析 A、酸中氢离子浓度与碱中氢氧根离子浓度相同时,对水的电离的抑制作用相同;
B、氢离子浓度和氢氧根离子浓度相同的酸碱溶液等体积混合,谁弱显谁性;
C、醋酸和一水合氨是弱电解质,盐酸和NaOH是强电解质,加水稀释,促进弱电解质的电离;
D、据电荷守恒分析.
解答 解:A、pH=2的CH3COOH溶液中氢离子浓度与pH=12的NaOH溶液中氢氧根离子浓度相同,对水的电离的抑制作用相同,所以①、④溶渡中水电离的c( H+):①=④,故A错误;
B、pH=12的氨水是弱碱只有部分电离,所以c(NH3•H2O)>c(OH-),HCl是强电解质,所以其溶液中c(HCl)=C(H+),c(NH3•H2O)>c(HCl),若将两溶液混合后溶液呈中性,则消耗溶液的体积:②>③,故B错误;
C、醋酸是弱酸,加水稀释后能促进醋酸的电离,所以①、②稀释后溶液的pH值7>②>①;氨水是弱碱,加水稀释后能促进氨水的电离,所以③、④、稀释后溶液的PH值③>④>7,所以向等体积的四种溶液中分别加入100mL水后,溶液的pH:③>④>②>①,故C错误;
D、将①、④溶液混合后pH=8,则c(H+)=1.0×10-8mol/L,c(OH-)=1.0×10-6mol/L,溶液中存在电荷守恒即c(Na+)+c(H+)=c(OH-)+c(CH3COO-),c(Na+)-c(CH3COO-)=c(OH-)-c(H+)=1.0×10-6mol/L-1.0×10-8mol/L=9.9×10-7mol•L-1,故D正确;
故选D.
点评 本题考查了弱电解质的电离、溶液稀释后PH值相对大小的比较等知识点,注意无论是水溶液还是碱溶液都抑制水的电离,题目不难.

练习册系列答案
相关题目
6.下列各对物质,互为同系物的是( )
| A. | CH3-CH═CH2与 | B. | 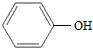 与 与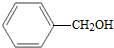 | ||
| C. | CH3COOCH3与CH3CH2COOCH3 | D. | CH3CH2Cl与CH3CHCl-CH2Cl |
13.某有机物的结构简式为: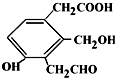 则Na、NaOH、NaHCO3分别与等物质的量的该物质反应时,消耗Na、NaOH、NaHCO3的物质的量之比为( )
则Na、NaOH、NaHCO3分别与等物质的量的该物质反应时,消耗Na、NaOH、NaHCO3的物质的量之比为( )
 则Na、NaOH、NaHCO3分别与等物质的量的该物质反应时,消耗Na、NaOH、NaHCO3的物质的量之比为( )
则Na、NaOH、NaHCO3分别与等物质的量的该物质反应时,消耗Na、NaOH、NaHCO3的物质的量之比为( )| A. | 3:3:3 | B. | 3:2:2 | C. | 3:2:1 | D. | 1:1:1 |
3.有机物的种类繁多,按系统命名法,下列有机物命名正确的是( )
| A. | 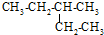 2-乙基丁烷 2-乙基丁烷 | B. | CH2=CHCH2CH3 丁烯 | ||
| C. | 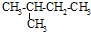 异戊烷 异戊烷 | D. | 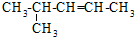 4-甲基-2-戊烯 4-甲基-2-戊烯 |
7.如图是有关电化学的图示,其中完全正确的是( )
| A. | 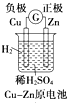 | B. | 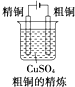 | C. | 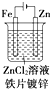 | D. | 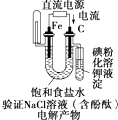 |
8.下列有关说法正确的是( )
| A. | 苯能与溴发生取代反应,因此不能用苯萃取溴水中的溴 | |
| B. | 甲烷、苯都属于烃,都不存在同分异构体 | |
| C. | 甲烷和乙烯可以用酸性高锰酸钾溶液鉴别 | |
| D. | 石油的裂解是化学变化,而石油的分馏和煤的干馏都是物理变化 |
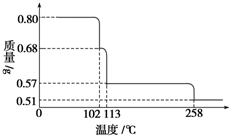 0.80g CuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.
0.80g CuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示. 硫代硫酸钠(Na2S2O3)是一种重要的化工产品,它受热,遇酸易分解,向Na2CO3和Na2S混合物中通入SO2可制得Na2S2O3,某兴趣小组用如图1实验装置制备硫代硫酸钠晶体(Na2S2O3•5H2O),回答下列问题:
硫代硫酸钠(Na2S2O3)是一种重要的化工产品,它受热,遇酸易分解,向Na2CO3和Na2S混合物中通入SO2可制得Na2S2O3,某兴趣小组用如图1实验装置制备硫代硫酸钠晶体(Na2S2O3•5H2O),回答下列问题: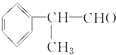 )是一种重要的化工原料,其合成路线如下
)是一种重要的化工原料,其合成路线如下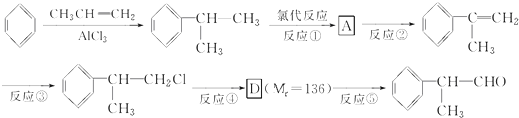
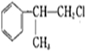 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$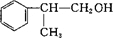 +NaCl.
+NaCl.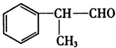 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$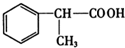 +Cu2O↓+2H2O.
+Cu2O↓+2H2O.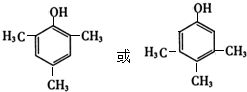 .
.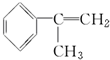 为原料制备
为原料制备 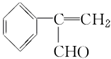 的化学方程式(无机试剂任用).
的化学方程式(无机试剂任用).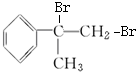 、
、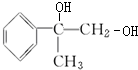 +2NaBr、
+2NaBr、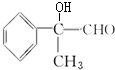 +2H2O、
+2H2O、