题目内容
(14分)以下是一些物质的熔沸点数据(常压):
| | 钾 | 钠 | Na2CO3 | 金刚石 | 石墨 |
| 熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
| 沸点(℃) | 774 | 882.9 | 1850(分解产生CO2) | --- | 4250 |
4Na(g)+3CO2(g)
 2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol
2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol(1)上述反应的平衡常数表达式为 ;若4v正(Na)=3v逆(CO2),反应是否达到平衡 (选填“是”或“否”)。
(2)若反应在10L密闭容器、常压下进行,温度由890℃升高到1860℃,若反应时间为10min,金属钠的物质的量减少了0.2mol,则10min里CO2的平均反应速率为 。
(3)高压下有利于金刚石的制备,理由 。
(4)由CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H=-357.5kJ/mol;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(1)的热化学方程式: 。
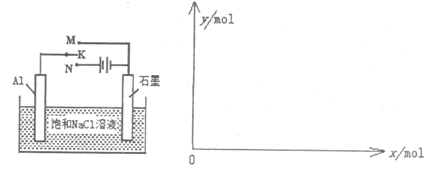
(5)下图开关K接M时,石墨作 极,电极反应式为 。当K接N一段时间后,测得有0.3mol电子转移,作出y随x变化的图象【x—代表n(H2O)消耗,y—代表n[Al(OH)3],反应物足量,标明有关数据】
(1) K=1/c4(Na) c3(CO2)(2分);否(1分) (2)0.0015 mol/(L ·min)(2分)
(3)增大压强加快反应速率,反应向正反应方向移动 (2分)
(4)6Na2O(s)+ 2C(s,金刚石)=8Na(g)+ 2Na2CO3(l)△H= —8.4 kJ/mol(2分)
(5)正(1分); O2+2H2O+4e-=4OH-(2分)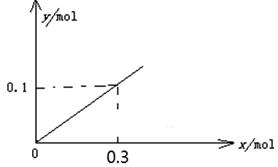 (2分)
(2分)
解析试题分析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,固体或纯液体不能出现在平衡常数表达式中,则该反应的平衡常数表达式为K=1/c4(Na) c3(CO2);若反应达到平衡状态,则根据反应速率之比是相应的化学计量数之比可知,3v正(Na)=4v逆(CO2),因此4v正(Na)=3v逆(CO2)时反应没有达到平衡状态。
(2)反应时间为10min,金属钠的物质的量减少了0.2mol,则根据方程式可知消耗CO2的物质的量是0.15mol,浓度是0.015mol/L,因此10min里CO2的平均反应速率为0.015mol/L÷10min=0.0015 mol/(L ·min)。
(3)根据方程式可知,正方应是体积增大的可逆反应,因此增大压强加快反应速率,反应向正反应方向移动,有利于金刚石的制备。
(4)根据反应①4Na(g)+3CO2(g) 2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol,②CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H=-357.5kJ/mol,则根据盖斯定律可知①-②×3即得到6Na2O(s)+ 2C(s,金刚石)=8Na(g)+ 2Na2CO3(l)△H= —8.4 kJ/mol。
2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol,②CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H=-357.5kJ/mol,则根据盖斯定律可知①-②×3即得到6Na2O(s)+ 2C(s,金刚石)=8Na(g)+ 2Na2CO3(l)△H= —8.4 kJ/mol。
(5)开关K接M时,构成原电池,铝是活泼的金属作负极,则石墨作正极,溶液性质中性,所以吸氧腐蚀,则正极电极反应式为O2+2H2O+4e-=4OH-。当K接N时构成电解池,铝是阳极失去电子,石墨是阴极溶液中的氢离子放电生成氢气,总反应式为2Al+6H2O 2Al(OH)3+3H2↑,因此一段时间后,测得有0.3mol电子转移,则消耗水的物质的量是0.3mol,生成氢氧化铝是0.1mol,因此y随x变化的图象为(见答案)。
2Al(OH)3+3H2↑,因此一段时间后,测得有0.3mol电子转移,则消耗水的物质的量是0.3mol,生成氢氧化铝是0.1mol,因此y随x变化的图象为(见答案)。
考点:考查平衡常数、反应速率、外界条件对平衡状态影响、热化学方程式阴极电化学原理应用

被称为人体冷冻学之父的罗伯特·埃廷格(Robert Ettinger)在1962年写出《不朽的前景》(The Prospect Of Immortality)一书。他在书中列举了大量事实,证明了冷冻复活的可能。比如,许多昆虫和低等生物冬天都冻僵起来,春天又自动复活。下列结论中与上述信息相关的是
| A.温度越低,化学反应越慢 | B.低温下分子无法运动 |
| C.温度降低,化学反应停止 | D.化学反应前后质量守恒 |
汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致: N2(g)+O2(g)? 2NO(g) ΔH>0,已知该反应在2 404 ℃ 时,平衡常数K=64×10-4。请回答:
2NO(g) ΔH>0,已知该反应在2 404 ℃ 时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5mol,则N2的反应速率________。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志________。
| A.消耗1 mol N2同时生成1 mol O2 | B.混合气体密度不变 |
| C.混合气体平均相对分子质量不变 | D.2v(N2)正=v(NO)逆 |
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数______。(填“变大、“变小”或“不变”)
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应___________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是____
(12分).
在1.0 L密闭容器中放入0.10molA(g),在一定温度进行如下反应:
A(g) B(g)+C(g) △H=+85.1kJ·mol-1(吸热反应)
B(g)+C(g) △H=+85.1kJ·mol-1(吸热反应)
反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为_______________。
(2)由总压强P和起始压强P0计算反应物A的转化率α(A)的表达式为_______。平衡时A 的转化率为_____.
(3) ①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),
n总=_______mol,n(A)=_______mol。
②下表为反应物A浓度与反应时间的数据,计算a= _______________
| 反应时间t/h | 0 | 4 | 8 | 16 |
| C(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.0065 |
分析该反应中反应物的浓度c(A)变化与时间间隔(△t)的规律,得出的结论是_________________,由此规律推出反应在12h时反应物的浓度c(A)为_______mol·L-1
(14分)短周期主族元素A、B、C、D、E原子序数依次增大 , A是元素周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C原子的最外层电子数是次外层电子数的3倍,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物分子含有相同的电子数。
⑴A、C、D形成的化合物中含有的化学键类型为 。
⑵已知:
① E-E→2E ?H=+a kJ/mol;
② 2A→A-A ?H=-b kJ/mol;
③ E+A→A-E ?H=-c kJ/mol;
写出298K时,A2与E2反应的热化学方程式 。
⑶在某温度下容积均为2 L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g) X(g) ?H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
X(g) ?H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2 mol A2、1 mol BC | 1 mol X | 4 mol A2、2 mol BC |
| 平衡时n(X) | 0.5 mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 |  1 1 |  2 2 |  3 3 |
v (A2)= 。
② 计算该温度下此反应的平衡常数K = 。
③三个容器中的反应分别达平衡时下列各组数据关系正确的是 (填字母)。
A.α1+α2=1 B.Q1+Q2=Q C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0 mol F.Q3=2Q1
④在其他条件不变的情况下,将甲容器的体积压缩到1 L,若在第8min达到新的平衡时A2的总转化率为75%,请在下图中画出第5min 到新平衡时X的物质的量浓度的变化曲线。
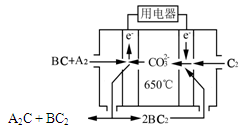
⑷熔融碳酸盐燃料电池(MCFC)是一种高温燃料电池,被称为第二代燃料电池,是未来民用发电的理想选择方案之一,其工作原理如图所示。现以A2(g)、BC(g)为燃料,以一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出该碳酸盐燃料电池(MCFC)正极的电极反应式____________________________。
 2NH3(g)
2NH3(g)  H=-92.2kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6LNH3时,放出的热量为 。
H=-92.2kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6LNH3时,放出的热量为 。
 CH3OH(g)。
CH3OH(g)。
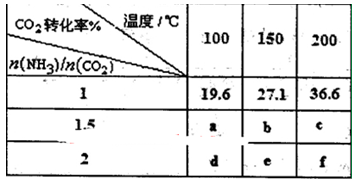
 =4时,CO2的转化率随时间的变化关系如图1所示.
=4时,CO2的转化率随时间的变化关系如图1所示.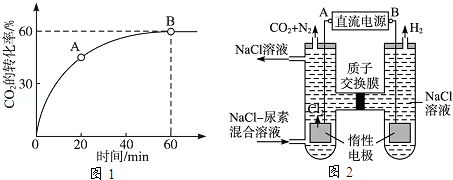

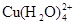 (aq) +4Cl-(aq)
(aq) +4Cl-(aq)
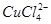 (aq) +4H2O(l)
(aq) +4H2O(l)