题目内容
(16分)合成氨技术的发明使工业化人工固氮成为现实。
(1)已知N2(g)+3H2(g)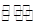 2NH3(g)
2NH3(g) 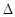 H=-92.2kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6LNH3时,放出的热量为 。
H=-92.2kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6LNH3时,放出的热量为 。
(2)合成氨混合体系在平衡状态时NH3的百分含量与温度的关系如下图所示。由图可知:
①温度T1、T2时的平衡常数分别为K1、K2,则K1 K2 (填“>”或“<”)。若在恒温、恒压条件下,向平衡体系中通入氦气,平衡 移动、(填“向左”、“向右”或“不”)。
②T2温度时,在1L的密闭容器中加入2.1mol N2、l.5molH2,经10min达到平衡,则v(H2)= 。达到平衡后,如果再向该容器内通入N2、H2、NH3各0.4mol,则平衡 移动(填“向左”、“向右”或“不”)。
(3)工业上用CO2和NH3反应生成尿素:CO2(g)+2NH3(g)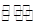 H2O(1)+CO(NH2)2(1) △H,
H2O(1)+CO(NH2)2(1) △H,
在一定压强下测得如下数据: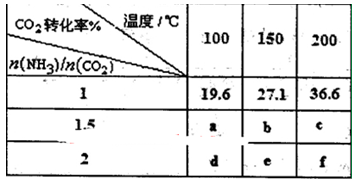
①则该反应△H 0,表中数据a d,b f(均选填“>”、‘‘=”或“<”)。
②从尿素合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理 。
(16分)
(1)69.15kJ(2分)
(2)① >(1分) 向左(1分) ②0.09 mol·L-1·min-1(2分) 向右(2分)
(3)①>(2分) < (2分) <(2分)
②净化后重新充入合成塔内,循环利用,提高原料利用率(2分)
解析试题分析:(1)标准状况下33.6LNH3物质的量为:33.6L÷22.4L/mol=1.5mol,92.2kJ·mol-1÷2×1.5mol=69.15kJ。
(2)①根据图像,B点NH3的百分含量小于A点NH3的百分含量,所以K1 > K2;若在恒温、恒压条件下,向平衡体系中通入氦气,原反应体系气体的压强减小,平衡向气体系数增大的方向移动,即向左移动。
②根据“三段式”进行计算,设N2转化浓度为X,则
N2(g)+3H2(g)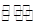 2NH3(g)
2NH3(g)
起始浓度(mol?L?1) 2.1 1.5 0
转化浓度(mol?L?1) X 3X 2X
平衡浓度(mol?L?1)2.1—X 1.5—3X 2X
根据T1时NH3的百分含量为20%,则2X/(2.1—X+1.5—3X+2X)=20%,解得X=0.3,则v(H2)=0.9mol/L÷10min="0.09" mol·L-1·min-1;根据平衡浓度可求平衡常数K=(0.6mol?L?1)2÷[1.8mol/L×(0.6mol?L?1)3]=0.93(mol?L?1)-2,再向该容器内通入N2、H2、NH3各0.4mol,则Q=(1mol?L?1)2÷[2.2mol/L×(1mol?L?1)3]=0.45(mol?L?1)-2,Q < K,所以平衡向右移动。
(3)①根据表中数据,温度升高,CO2的转化率增大,平衡向右移动,所以正反应为吸热反应,?H > 0;n(NH3)/n(CO2)增大,CO2的转化率增大,所以a < d,b <f。
②CO2、NH3为反应物,所以净化后重新充入合成塔内,循环利用,提高原料利用率。
考点:本题考查化学反应与热量变化、反应速率、平衡常数、化学平衡移动、化学计算。

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案可逆反应∶2NO2 2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2的同时,生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥ 混合气体的平均相对分子质量不再改变的状态
| A.①④⑥ | B.②③⑤ | C.①③④ | D.①②③④⑤ |
(10分)800℃、2L密闭容器反应2NO(g)+O2(g) 2NO2(g)体系中, n(NO)随
2NO2(g)体系中, n(NO)随
时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)反应进行到2 s时c (NO)= 。
(2)用O2表示从0~2s内该反应的平均速率υ=___________。
 (3) 反应达到平衡状态时NO的转化率= 。(提示 : )
(3) 反应达到平衡状态时NO的转化率= 。(提示 : )(4)判断一可逆反应是否达到平衡状态的依据有很多,某同学针对该反应提出一种设想:测定容器内气体的密度,当密度不再改变时即可判断出该反应已经达到平衡状态。你认为这种设想是否正确? (填“是”或“否”)请说明你的理由 。
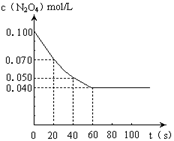
已知:N2O4(g)  2NO2(g) ΔH="+57.20kJ" · mol-1
2NO2(g) ΔH="+57.20kJ" · mol-1
在100℃时,将0.100molN2O4气体充入1L恒容抽空的密闭容器中,每隔一定时间对该容器内的物质浓度进行分析得到下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4) /mol··L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2) /mol·L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
(1) 该反应的平衡常数表达式为 ______;从表中数据分析:
c1 c2 (填“>” 、“<” 或“="”" )。
(2)下列叙述能证明该反应已达到化学平衡状态的是
A.容器内压强不再发生变化
B.NO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗n mol N2O4的同时生成2n mol NO2
E.反应体系中NO2、N2O4的体积比为1:2
(3)若起始时充入NO2气体0.200mol,则达到平衡时NO2气体的转化率为a;其它条件不变时,下列措施能提高NO2转化率的是 (填字母)。
A.降低温度
B.减小NO2的浓度
C.升高温度
D.增加NO2的浓度
E.再充入一定量的He
(14分)以下是一些物质的熔沸点数据(常压):
| | 钾 | 钠 | Na2CO3 | 金刚石 | 石墨 |
| 熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
| 沸点(℃) | 774 | 882.9 | 1850(分解产生CO2) | --- | 4250 |
4Na(g)+3CO2(g)
 2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol
2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol(1)上述反应的平衡常数表达式为 ;若4v正(Na)=3v逆(CO2),反应是否达到平衡 (选填“是”或“否”)。
(2)若反应在10L密闭容器、常压下进行,温度由890℃升高到1860℃,若反应时间为10min,金属钠的物质的量减少了0.2mol,则10min里CO2的平均反应速率为 。
(3)高压下有利于金刚石的制备,理由 。
(4)由CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H=-357.5kJ/mol;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(1)的热化学方程式: 。
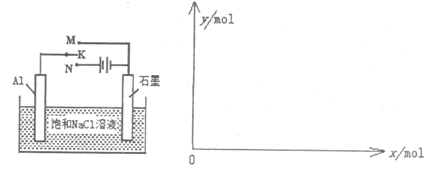
(5)下图开关K接M时,石墨作 极,电极反应式为 。当K接N一段时间后,测得有0.3mol电子转移,作出y随x变化的图象【x—代表n(H2O)消耗,y—代表n[Al(OH)3],反应物足量,标明有关数据】
 N2O4(g) (无色),如图所示。
N2O4(g) (无色),如图所示。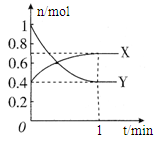
 xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,C的平均反应速率为0.1 mol/(L·min)。试求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,C的平均反应速率为0.1 mol/(L·min)。试求: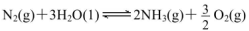
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。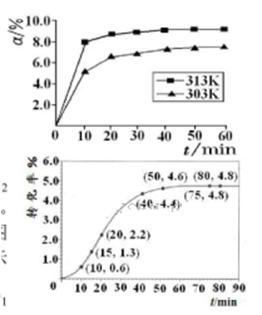
 盐酸与0.2 mol
盐酸与0.2 mol (25℃时,NH3.H2O的电离常数
(25℃时,NH3.H2O的电离常数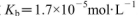 )
)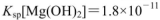 ,
,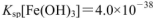 )
) 2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)