题目内容
据图回答下列问题: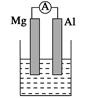
Ⅰ、(1)若烧杯中溶液为稀硫酸,则观察到的现象是______________________
负极反应式为:_________________________________________________。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为________(填Mg或Al),总反应化学方程式为
______________________________________________________________。
Ⅱ、由Al、Cu、浓硝酸组成原电池,其正极的电极反应式为
Ⅲ、(1)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇: CO(g)+2H2(g)  CH3OH(g)。
CH3OH(g)。
分析该反应并回答下列问题:下列各项中,不能够说明该反应已达到平衡的是________(填序号)。
a.恒温、恒容条件下,混合气体的平均相对分子质量不变
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗2 mol H2,同时生成1 mol CH3OH
(2)2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如下图所示。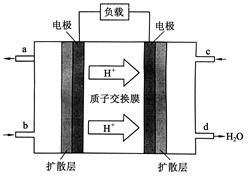
①该电池工作时,b口通入的物质为________________,
c口通入的物质为________________。
②该电池负极的电极反应式为:_______
③工作一段时间后,当6.4 g甲醇完全反应生成CO2时,
有______________NA个电子转移。
I(1)Mg逐渐溶解,Al片上有气泡冒出,指针偏转;Mg-2e-=Mg2+
(2)Al;2Al+2NaOH+2H2O=2NaAlO2+3H2↑
II.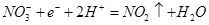
III.(1)d(2)①CH3OH;O2或空气②CH3OH-6e-+H2O=CO2+6H+ ③1.2
解析试题分析:Ⅰ、(1)若烧杯中溶液为稀硫酸,则镁为负极,观察到的现象是Mg逐渐溶解,Al片上有气泡冒出,指针偏转;负极反应式为Mg-2e-=Mg2+;(2)若烧杯中溶液为氢氧化钠溶液,则负极为Al,总反应化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;Ⅱ、由Al、Cu、浓硝酸组成原电池,Al在浓硝酸中钝化,则Cu为负极,正极的电极反应式为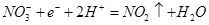 ;Ⅲ、(1)a.恒温、恒容条件下,混合气体的平均相对分子质量不变,说明各组分物质的量不再改变,反应达平衡;b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等,正逆反应速率相等,反应达平衡;c.一定条件下,CO、H2和CH3OH的浓度保持不变,说明已经平衡;d.一定条件下,单位时间内消耗2 mol H2,同时生成1 mol CH3OH,为同一个方向,不能说明是否平衡;故选d。(2)所给甲醇燃料电池工作时,b为负极通入的物质为CH3OH;c口通入的物质为O2或空气;负极的电极反应式为CH3OH-6e-+H2O=CO2+6H+;工作一段时间后,当6.4 g甲醇完全反应生成CO2时,转移1.2mol电子,即有1.2NA个电子转移。
;Ⅲ、(1)a.恒温、恒容条件下,混合气体的平均相对分子质量不变,说明各组分物质的量不再改变,反应达平衡;b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等,正逆反应速率相等,反应达平衡;c.一定条件下,CO、H2和CH3OH的浓度保持不变,说明已经平衡;d.一定条件下,单位时间内消耗2 mol H2,同时生成1 mol CH3OH,为同一个方向,不能说明是否平衡;故选d。(2)所给甲醇燃料电池工作时,b为负极通入的物质为CH3OH;c口通入的物质为O2或空气;负极的电极反应式为CH3OH-6e-+H2O=CO2+6H+;工作一段时间后,当6.4 g甲醇完全反应生成CO2时,转移1.2mol电子,即有1.2NA个电子转移。
考点:考查原电池原理等相关知识。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案已知:N2O4(g)  2NO2(g) ΔH="+57.20kJ" · mol-1
2NO2(g) ΔH="+57.20kJ" · mol-1
在100℃时,将0.100molN2O4气体充入1L恒容抽空的密闭容器中,每隔一定时间对该容器内的物质浓度进行分析得到下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4) /mol··L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2) /mol·L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
(1) 该反应的平衡常数表达式为 ______;从表中数据分析:
c1 c2 (填“>” 、“<” 或“="”" )。
(2)下列叙述能证明该反应已达到化学平衡状态的是
A.容器内压强不再发生变化
B.NO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗n mol N2O4的同时生成2n mol NO2
E.反应体系中NO2、N2O4的体积比为1:2
(3)若起始时充入NO2气体0.200mol,则达到平衡时NO2气体的转化率为a;其它条件不变时,下列措施能提高NO2转化率的是 (填字母)。
A.降低温度
B.减小NO2的浓度
C.升高温度
D.增加NO2的浓度
E.再充入一定量的He
(14分)以下是一些物质的熔沸点数据(常压):
| | 钾 | 钠 | Na2CO3 | 金刚石 | 石墨 |
| 熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
| 沸点(℃) | 774 | 882.9 | 1850(分解产生CO2) | --- | 4250 |
4Na(g)+3CO2(g)
 2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol
2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol(1)上述反应的平衡常数表达式为 ;若4v正(Na)=3v逆(CO2),反应是否达到平衡 (选填“是”或“否”)。
(2)若反应在10L密闭容器、常压下进行,温度由890℃升高到1860℃,若反应时间为10min,金属钠的物质的量减少了0.2mol,则10min里CO2的平均反应速率为 。
(3)高压下有利于金刚石的制备,理由 。
(4)由CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H=-357.5kJ/mol;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(1)的热化学方程式: 。
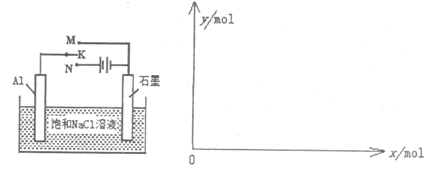
(5)下图开关K接M时,石墨作 极,电极反应式为 。当K接N一段时间后,测得有0.3mol电子转移,作出y随x变化的图象【x—代表n(H2O)消耗,y—代表n[Al(OH)3],反应物足量,标明有关数据】
 NaNO3(s)+ClNO(g) K1 ?H < 0 (I)
NaNO3(s)+ClNO(g) K1 ?H < 0 (I) Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。 xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,C的平均反应速率为0.1 mol/(L·min)。试求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,C的平均反应速率为0.1 mol/(L·min)。试求: CaO(s) + SO2(g) + CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ)
CaO(s) + SO2(g) + CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ) 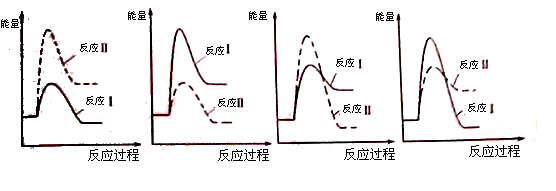
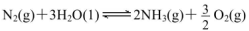
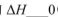 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。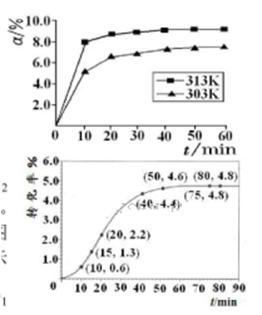
 盐酸与0.2 mol
盐酸与0.2 mol (25℃时,NH3.H2O的电离常数
(25℃时,NH3.H2O的电离常数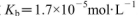 )
)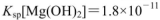 ,
,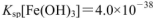 )
) 2NH3(g);△H=-92.4kJ?mol-1。下图1是在两种不同实验条件下模拟化工生产进行实验所测得N2随时间变化示意图。
2NH3(g);△H=-92.4kJ?mol-1。下图1是在两种不同实验条件下模拟化工生产进行实验所测得N2随时间变化示意图。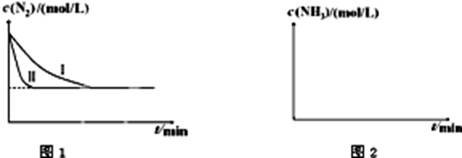
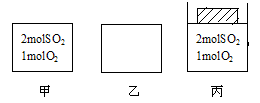
 2SO3至平衡。
2SO3至平衡。