题目内容
【题目】甲醇不仅是重要的化工原料,而且还是性能优良的能源和车用燃料。
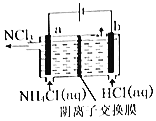
Ⅰ.甲醇水蒸气重整制氢是电动汽车氢氧燃料电池理想的氢源,生产过程中同时也产生CO,CO会损坏燃料电池的交换膜。相关反应如下:
反应①CH3OH(g) + H2O(g)CO2(g) + 3H2(g) △H1
反应②H2(g)+CO2(g)CO(g) + H2O(g) △H2=+41kJ/mol
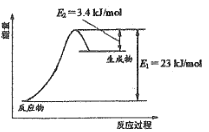
如图表示恒压容器中0.5mol CH3OH(g)和0.5mol H2O(g)转化率达80%时的能量变化。
(1)计算反应①的△H1= ________。
(2)反应①能够自发进行的原因是________。升温有利于提高CH3OH转化率,但也存在一个明显的缺点是 _________。
(3)恒温恒容下,向密闭容器中通入体积比为1:1的H2和CO2,能判断反应CH3OH(g) + H2O(g)CO2(g) + 3H2(g)处于平衡状态的是____________。
A.体系内压强保持不变
B.体系内气体密度保持不变
C.CO2的体积分数保持不变
D.断裂3mol H-H键的同时断裂3mol H-O键
(4)250℃,一定压强和催化剂条件下,1.00mol CH3OH 和 1.32mol H2O充分反应,平衡测得H2为2.70mol,CO为 0.030mol,则反应①中CH3OH的转化率_________,反应②的平衡常数是 _________(以上结果均保留两位有效数字)。
Ⅱ.如图是甲醇燃料电池工作示意图:
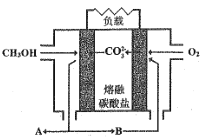
(5)当内电路转移1.5molCO32-时,消耗甲醇的质量是_________g。
(6)正极的电极反应式为 _______。
【答案】+49kJ/mol 该反应为熵增加的反应,熵增效应大于能量效应 CO含量增高,会破坏该电池的交换膜 ACD 91% 5.6×10-3 16g O2+2CO2+4e-=2CO32-
【解析】
(1)由图可知,0.5mol CH3OH(g)和0.5mol H2O(g)转化率达80%即0.4mol时吸收能量23kJ-3.4kJ=19.6kJ,计算1molCH3OH(g)和H2O(g)转化的能量可得;
(2)根据熵变分析;升温有利于提高CH3OH转化率,促进CO的生成,破坏电池交换膜;
(3)根据化学平衡状态特征:正逆反应速率相等,各组分含量保持不变分析;
(4)根据题意,衡时测得H2为2.70mol,CO为0.030mol,说明反应②生成的H2O(g)为0.03mol,消耗CO2(g)为0.03mol,参与反应②的H2为2.73mol,由反应①生成,则反应①生成CO2(g)为0.91mol,反应中的CO2(g)为0.88mol,根据反应①生成H2为2.73mol,生成CO2(g)为0.91mol,则参与反应的 CH3OH为0.91mol,H2O(g)为0.91mol,故装置中CH3OH为0.09mol,H2O(g)为1.32mol-0.91mol+0.03mol=0.44mol,H2为2.70mol,CO为0.030mol,CO2(g)为0.88mol,结合转化率=变化量除以起始量和反应②的K= ![]() 计算;
计算;
(5)甲醇燃料电池甲醇为负极,电极反应为:2CH3OH-12e-+6CO32-=8CO2+4H2O,据此计算;
(6)正极为氧气发生氧化反应,结合电解质可得。
(1)由图可知,0.5mol CH3OH(g)和0.5mol H2O(g)转化率达80%即0.4mol时吸收能量23kJ-3.4kJ=19.6kJ,则1molCH3OH(g)和H2O(g)转化的能量![]() =49kJ,故反应①的△H1=+49kJ/mol;
=49kJ,故反应①的△H1=+49kJ/mol;
(2)反应①的△H>0,但熵增加△S>0,根据△G=△H-T△S<0时反应自发进行可知当达到一定温度时,该反应可以自发进行,即该反应能自发进行是由于熵增效应大于能量效应;升温有利于提高CH3OH转化率,促进CO的生成,提高CO的产量,但CO会破坏该电池的交换膜;
(3)A.该反应前后气体系数之和不同,平衡移动过程中压强会发生变化,所以体系内压强保持不变时说明反应达到平衡,故A正确;
B.体系内混合气体总质量保持不变,恒容体积不变,气体密度始终保持不变,不能判断化学平衡,故B错误;
C.反应达到平衡时各组分含量保持不变,所以CO2的体积分数保持不变说明反应达到平衡,故C正确;
D.断裂3mol H-H键的同时断裂3mol H-O键,说明消耗3mol氢气的同时消耗1mol甲醇和1mol水,说明正逆反应速率相等,反应达到平衡,故D正确;
综上所述选ACD;
(4)根据题意,衡时测得H2为2.70mol,CO为0.030mol,说明反应②生成的H2O(g)为0.03mol,消耗CO2为0.03mol,则反应①生成的H2为2.73mol,则反应①生成CO2为0.91mol,平衡时的CO2为0.88mol;反应①生成H2为2.73mol,生成CO2为0.91mol,则转化的 CH3OH为0.91mol,H2O为0.91mol,故平衡时CH3OH为0.09mol,H2O为1.32mol-0.91mol+0.03mol=0.44mol,H2为2.70mol,CO为0.030mol,CO2为0.88mol,所以甲醇的转化率为![]() =91%;反应②为前后气体系数之和相等的可逆反应,所以计算平衡常数时可用物质的量代替浓度,所以平衡常数K=
=91%;反应②为前后气体系数之和相等的可逆反应,所以计算平衡常数时可用物质的量代替浓度,所以平衡常数K=![]() =5.6×10-3;
=5.6×10-3;
(5)甲醇燃料电池甲醇为负极,电极反应为:2CH3OH-12e-+6CO32-=8CO2+4H2O,当内电路转移1.5mol CO32-时,消耗甲醇为0.5mol,故消甲醇的质量是0.5mol×32g/mol=16g;
(6)通入氧气的一极为正极,结合负极产生的二氧化碳生成碳酸根,电极方程式为O2+2CO2+4e-=2CO32-。